Інфаркт міокарда: детально
Визначення
ІМ — це некроз серцевого м’яза (загибель кардіоміоцитів), що виникає в результаті гострої недостатності коронарного кровообігу, спричиненої порушенням балансу між перфузією міокарда і його метаболічними процесами. Це захворювання дуже поширене. У США від ІХС щорічно помирають 500 тис. хворих, близько 200–300 тис. пацієнтів помирають від ІМ, який трапляється кожні 20 с і щохвилини від нього помирає один хворий. В Україні щорічно діагностується близько 50 тис. випадків ІМ. Можна припустити, що кількість ІМ в Україні має становити 110–150 тис. випадків щороку, з яких ⅔ — випадки з елевацією сегмента ST.
Зміст
- Визначення
- Етіологія
- Патанатомія
- Класифікація
- Етапність надання медичної допомоги
- Перелік фармакологічних препаратів для лікування при ГКС з елевацією сегмента ST та його можливих ускладнень
- Інтервенційні та хірургічні методи лікування
- Антитромбоцитарна терапія хворих після проведення планових ПКВ
- Лікувальна тактика гострого ІМ
- Кардіогенний шок
- Помилки та необґрунтовані призначення у разі недотримання рекомендацій доказової медицини
Етіологія
Основною причиною розвитку ІМ є атеросклероз КА (95% випадків). У 5% випадків може виникнути ІМ некоронарного походження (інфекційний ендокардит, ревматизм, внутрішньошлуночкові тромби, коронарити, системний червоний вовчак, ревматоїдний артрит тощо).
Патанатомія
При гострому ІМ визначають поліморфні ядерні лейкоцити в міокарді, при рубцюванні — мононуклеарні клітини і фібробласти.
Основні патогенетичні ланки ІМ:
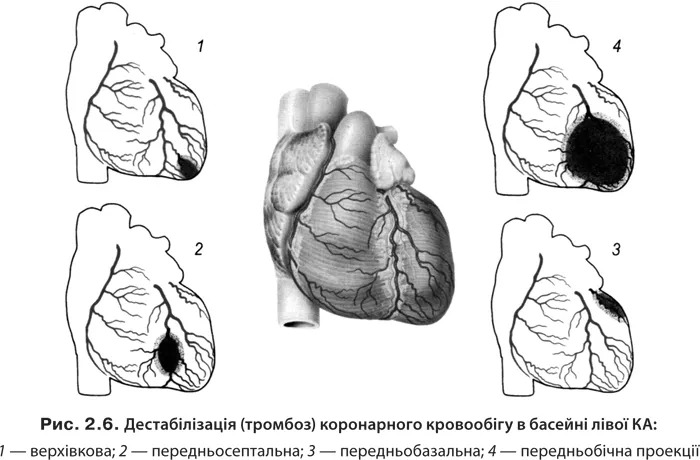
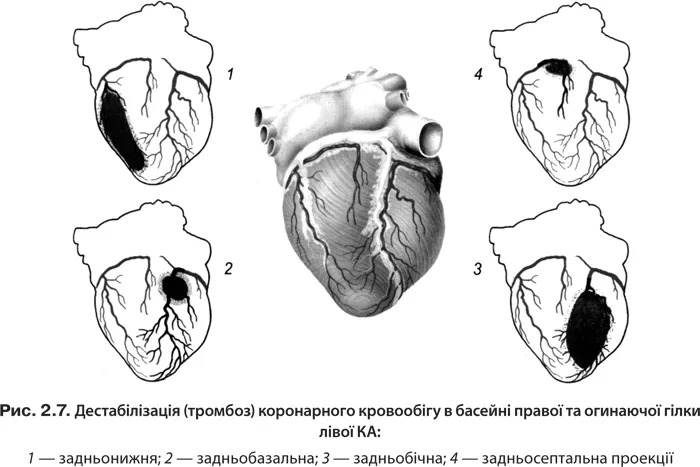
1. Розрив атеросклеротичної бляшки (надрив, ерозія) призводить до утворення тромбоцитарного (білий) та еритроцитарного, фібринового (червоний) тромбів з розвитком гострої ішемії міокарда. Для повного некрозу усіх клітин міокарда необхідно ≥2–4 год залежно від стану колатерального кровотоку чи оклюзії КА (рис. 2.6, 2.7).
2. Відбувається активація симпатичної НС, ренін-ангіотензин-альдостеронової системи (РААС), вазопресорів (тромбоксан А2, ендотелін, ангіотензин ІІ) та зниження синтезу вазодилататорів (оксид азоту, простациклін), у кардіоміоцитах накопичується кальцій, що призводить до розвитку вираженого спазму КА.
3. В результаті гіпоксії знижується синтез аденозинтрифосфату (АТФ), розвивається метаболічний ацидоз, що призводить до активації ПОЛ, зниження АОСЗ, виникнення СН (енергетичної недостатності) та електричної нестабільності міокарда.
4. Розвивається ремоделювання (розширення серця призводить до зміни його конфігурації та геометрії), систолічна (зменшується ФВ) та діастолічна (порушується її фазова структура) дисфункція міокарда.
Класифікація
Сучасна класифікація (табл. 2.31) ІМ здійснюється за такими ознаками:
- за величиною та глибиною ураження серцевого м’яза;
- за характером перебігу захворювання;
- за локалізацією ІМ;
- за наявністю ускладнень ІМ.
| Тип ІМ | Характеристика |
| 1 | Спонтанно виниклий ІМ, спричинений ішемією внаслідок ускладненого перебігу атеросклерозу КА, при якому розвивається ерозія атеросклеротичної бляшки і/або її розрив, розтріскування, розшарування |
| 2 | ІМ, що виник внаслідок ішемії, спричинений збільшенням потреби міокарда в кисні або зниженням його доставки (при спазмі КА, емболії КА, анемії, аритмії, АГ або артеріальній гіпотензії) |
| 3 | Раптова непередбачена смерть, що включає гостру зупинку кровообігу, при якій визначаються симптоми ішемії міокарда і підйом сегмента ST від ізолінії або розвиток гострої БЛНПГ, або ознаки розвинутого тромбозу за даними ангіографії КА і/чи аутопсії, але тільки у разі настання смерті до того моменту, коли можна взяти аналіз крові на біомаркери та їх раннє підвищення |
| 4а | ІМ, пов’язаний із ПКВ на КА |
| 4б | ІМ, пов’язаний із тромбозом стента за даними ангіографії КА або аутопсії |
| 5 | ІМ, пов’язаний із коронарним шунтуванням |
За величиною виділяють ІМ з елевацією сегмента SТ (Q-ІМ) та без елевації сегмента SТ на ЕКГ (не Q-ІМ).
За характером перебігу захворювання розрізняють первинний, повторний (після 28 днів) та рецидивуючий (від 3 до 28 днів) ІМ.
За локалізацією виділяють передній, передньосептальний, передньоверхівковий, передньобічний, діафрагмальний, нижньобічний, нижньобазальний, бічний, задній, задньобазальний, задньобічний, задньосептальний, септальний, ПШ.
За стадією перебігу захворювання розрізняють:
- найгостріший (ішемічний) період — до 3 год від початку ІМ;
- гострий період — до 7 днів від початку ІМ;
- підгострий період — від 8 до 28 діб;
- рубцювання — ≥29 діб.
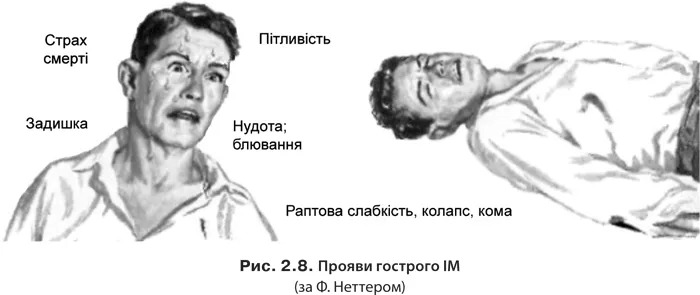
Продромальний період характеризується появою або частими нападами стенокардії. Найгостріший ІМ триває від початку нападів стенокардії до початку появи ознак некрозу серцевого м’яза за даними ЕКГ. Гострий період характеризується резорбцією некротичних мас і початком формування зубця Q (рис. 2.8).
Після 2 діб ІМ формується резорбційно-некротичний синдром. У разі відсутності ефективного колатерального кровообігу і тотальної оклюзії великої КА вже через 15 хв розпочинається загибель кардіоміоцитів; через 1 год гине близько 50% кардіоміоцитів у зоні ішемії, через 3 год — 80%, а через 6 год — майже 100% кардіоміоцитів. У підгострий період зменшуються ознаки СН і резорбційно-некротичного синдрому. В післяінфарктний період консолідується рубець, організм адаптується до нових умов функціонування.
До найпоширеніших ускладнень ІМ належать такі:
- ГСН (І–ІV клас за Kіllіp) і кардіогенний шок;
- порушення серцевого ритму та провідності;
- розрив серця (зовнішній і внутрішній);
- тромбоемболії різної локалізації;
- тромбоутворення в порожнинах серця;
- гостра аневризма серця;
- синдром Дресслера;
- рання постінфарктна стенокардія.
Клініка і діагностика ІМ наведені в алгоритмі 2.9.
| Алгоритм 2.9. Діагностика ІМ 1. Основні клінічні критерії: сильний, нестерпний, пекучий, стискаючий біль за грудниною тривалістю >20 хв, що іррадіює в ліву руку та лопатку, який не купірується нітрогліцерином. Атипові форми ІМ: астматична — основними симптомами є задишка та лівошлуночкова недостатність; гастралгічна — біль у животі, нудота, блювання; аритмічна — порушення ритму та провідності серця; церебральна — порушення мозкового кровообігу; мало- чи безсимптомна — без анамнезу; колаптоїдна (шокова) — з падінням АТ; атипова локалізація болю — біль іррадіює в нижню щелепу, праву руку, спину, зуби тощо; у людей похилого віку — млявість, зниження фізичного навантаження, задишка, прояви СН. 2. ЕКГ-критерії: найгостріша стадія — куполоподібний підйом сегмента ST на фоні позитивного зубця Т, який часто різко збільшується у двох послідовних відведеннях, а зубець R збільшується у відведеннях, у яких спостерігається зміщення сегмента ST від ізолінії [48]; гостра стадія — поява патологічного зубця Q, куполоподібне зміщення сегмента ST, виникнення негативного зубця T); підгостра стадія — наближення сегмента ST до ізолінії, негативний зубець Т; стадія рубцювання — сегмент ST знаходиться на ізолінії, а зубець Т може залишатися негативним, двофазним. За допомогою ЕКГ встановлюється локалізація ІМ: 1) передньосептальний — зміни в І, аVL, V1–2 відведеннях; 2) передньобічний — зміни в І, V5–6; 3) передній поширений — зміни в І, V1–6; 4) задній — зміни в ІІІ, аVF; 5) задньобічний — зміни в ІІІ, аVF, V5–6; 6) верхівковий — зміни в V4; 7) бічний — зміни в V5–6; 8) циркулярний — зміни в ІІІ, аVF, V1–6 відведеннях. 3. Підвищення в крові концентрації тропоніну Т, І, КФК-МВ. Кардіоспецифічні серцеві тропоніни використовують як оптимальні біомаркери. Визначення тропонінів дозволяє виявити ураження міокарда у третини пацієнтів із ІХС, в яких не підвищувалась КФК-МВ. Рівень тропонінів зростає через 6 год після розвитку ІМ і залишається підвищеним протягом 7–14 днів. При гострому ІМ кількість тропонінів збільшується у ≥3 рази. Якщо рівень тропонінів різко зростає без клінічно підтвердженої ішемії, слід шукати інші причини його зростання. |
Нормативи маркерів ураження міокарда наведені у схемі 2.3.
Діагноз повторного ІМ встановлюється тоді, коли рівень біомаркерів підвищується на ≥20%. При різкому і значному підвищенні вмісту тропонінів (у ≥3 рази) встановлюють діагноз ІМ без підйому сегмента ST.
Зміни ЕКГ, пов’язані з раніше перенесеним ІМ:
1. Зубець Q у відведеннях V2–V3 тривалістю ≥0,04 с або комплекс QS у відведеннях V2 і V3.
2. Зубець Q тривалістю ≥0,04 с і глибиною ≥0,1 мВ або комплекс QS у відведеннях І, ІІ, aVL, aVF чи V4–V6 у будь-яких двох відведеннях сусідніх груп відведень (І, aVL, V6; V4–V6; ІІ, ІІІ, aVF)*.
3. Зубець R тривалістю ≥0,04 с у відведеннях V1–V2 і відношення амплітуди зубців R/S, що дорівнює ≥1, у поєднанні з конкордантним позитивним зубцем Т за відсутності порушень провідності (табл. 2.32).
Примітка. *Такі ж критерії використовують при аналізі допоміжних відведень V7–V9 і для групи фронтальних відведень за Кабрера.
| Тип змін | Характеристика змін |
| Несправжньо позитивні | Слабовиражена рання реполяризація шлуночків. БЛНПГ. Синдром Бругада. Передчасне збудження шлуночків. Перикардит і/або міокардит. ТЕЛА. Субарахноїдальний крововилив. Неможливість визначення нормальних меж зміщення точки. Метаболічні порушення (наприклад гіперкаліємія) |
| Несправжньо негативні | Раніше перенесений ІМ з формуванням зубця Q і/або стійкий підйом сегмента ST вище ізолінії. Ритм електрокардіостимулятора (ЕКС). БЛНПГ |
Відомо, що підвищення рівня тропонінів можливе при різних патологічних і функціональних станах.
За останні роки з’явилася нова інформація щодо гострого ІМ з підйомом сегмента ST (ІМпST), яка включена в Рекомендації ESC, 2017:
1. Виключити в рекомендаціях ESC, 2012, термін «двері — балон», оскільки в сучасних умовах лікування може проводитись як у лікарні, так і при наданні швидкої допомоги.
2. Початок розвитку ІМ визначається з моменту підтвердження ІМ на ЕКГ.
3. Максимальний термін затримки проведення тромболізису від початку діагностики ІМ необхідно скоротити до 10 хв (було 20 хв).
4. При стентуванні КА використовувати лише стенти, покриті ліками, а не металеві стенти. Втручання на інфарктзв’язаних артеріях може проводитись як під час первинного ПКВ, так і в інший термін до виписки хворого зі стаціонару.
5. В окремих випадках подвійну антитромбоцитарну терапію можна продовжувати більше 12 міс. У нових рекомендаціях з’явився антиагрегант конгрелол для лікування окремих пацієнтів.
6. Хворим з ІМпST при високому вмісті ліпідів додатково призначають статини у високих дозах.
7. Поява на ЕКГ свіжої повної БПНПГ служить вагомою ознакою для проведення екстреної коронарографії, як і винесення повної БЛНПГ.
8. У 14% при ІМпST не діагностують обструкції (тромбоз) КА, тому в таких випадках використовують допоміжні діагностичні тести та дещо іншу тактику лікування.
Лікування ГКС з елевацією сегмента ST (ІМ із зубцем Q) (ВАКУ, 2018)
Етапність надання медичної допомоги
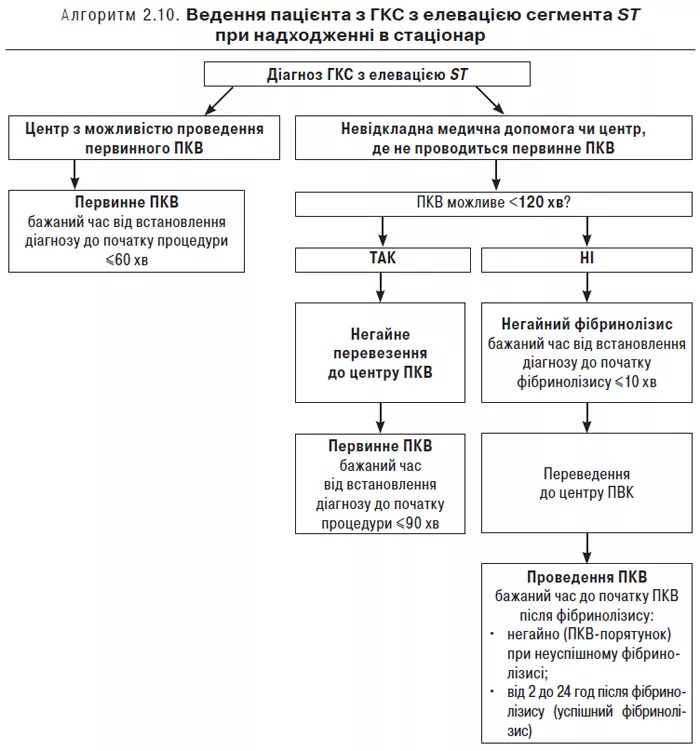
Основні компоненти медичної допомоги пацієнтам з ГКС з елевацією сегмента ST надають у спеціалізованому відділенні з можливістю проведення ПКВ. Пацієнти з підозрою на ГКС з елевацією сегмента ST доправляються до спеціалізованого відділення каретою швидкої медичної допомоги згідно із системою надання невідкладної медичної допомоги МОЗ України з місця розвитку ГКС або транспортуються з іншого закладу охорони здоров’я, де немає можливості проведення невідкладних коронарних втручань (алгоритм 2.10).
Цільові інтервали госпіталізації при STEMI наведені в табл. 2.33.
| Інтервал | Цільовий час |
| Максимальний час від ПМК до реєстрації ЕКГ і встановлення діагнозу* | ≤10 хв |
| Максимальний час з моменту встановлення діагнозу SТЕМІ до ПКВ (відкриття інфарктзалежної артерії); якщо цей часовий проміжок не дотримується, необхідно розглядати проведення тромболізису | ≤120 хв |
| Максимальний час з моменту встановлення діагнозу SТЕМІ до відкриття інфарктзалежної артерії в пацієнтів, доставлених до ПКВ-центру | ≤60 хв |
| Максимальний час з моменту встановлення діагнозу SТЕМІ до відкриття інфарктзалежної артерії в пацієнтів, переведених до ПКВ-центру | ≤90 хв |
| Максимальний час з моменту встановлення діагнозу SТЕМІ до початку інфузії тромболітика в пацієнтів, які вийшли за часові рамки щодо виконання первинного ПКВ | ≤10 хв |
| Часовий інтервал від початку тромболізису до оцінювання його ефективності (успішний чи неуспішний) | 60–90 хв |
| Часовий інтервал від початку тромболізису до виконання коронароангіографії (за успішного тромболізису) | 2–24 год |
Примітка. ПМК — перкутанна мітральна комісуротомія. *Інтерпретація ЕКГ повинна бути виконана невідкладно.
Первинний етап
Догоспітальний етап включає координацію надання першої медичної та екстреної медичної допомоги пацієнтам з гострим ІМ з моменту виявлення пацієнта або звернення такого пацієнта (родичів або свідків) за медичною допомогою до моменту госпіталізації. Надання першої медичної чи екстреної медичної допомоги на догоспітальному етапі здійснюється:
- диспетчером центру прийому викликів швидкої допомоги (первинна консультативно-діагностична допомога та організація подальших дій бригади швидкої допомоги);
- бригадами екстреної швидкої допомоги центрів екстреної медичної допомоги та медицини катастроф, станцій екстреної (швидкої) медичної допомоги, лікарями відділень екстреної (невідкладної) медичної допомоги багатопрофільних лікарень, які входять у систему екстреної медичної допомоги;
- бригадами пунктів невідкладної медичної допомоги для дорослого/дитячого населення;
- лікарями загальної практики — сімейними лікарями, лікарями інших спеціальностей (у разі виявлення такого пацієнта у помешканні чи на прийомі).
На догоспітальному етапі (диспетчер швидкої медичної допомоги):
1. Первинна верифікація діагнозу ГКС.
2. Запропонувати до приїзду спеціалізованої бригади прийняти:
- АСК (розжувати) у дозі 150–325 мг;
- нітрогліцерин (під язик).
3. Направити на виклик звичайну чи спеціалізовану бригаду.
4. Проінформувати спеціалізований стаціонар про наявність хворого з ГКС.
На догоспітальному етапі (бригада швидкої допомоги):
1. Верифікація діагнозу ГКС.
2. Застосовувати АСК у дозі 150–325 мг (якщо доти не приймалася), тікагрелор у дозі 180 мг (якщо планується транспортування хворого для проведення первинної ПКВ) або клопідогрель у дозі 300 мг.
3. Посиндромна терапія.
4. Вирішення питання про необхідність проведення ургентної реперфузії міокарда.
Пріоритетним завданням є транспортування хворого до стаціонару з можливістю проведення ангіографії та первинного ПКВ (тобто ангіопластики/стентування інфарктзалежної КА), якщо це можна зробити протягом 120 хв від першого медичного контакту із хворим; за відсутності такої можливості необхідне проведення догоспітального тромболізису (згідно з протоколом) або транспортування до стаціонару для проведення госпітального тромболізису (у разі, якщо спеціалізована бригада не може провести догоспітальний тромболізис на етапі транспортування хворого).
Вторинний етап
На етапі стаціонару без лабораторії (відділення) інтервенційної кардіології (за відсутності умов транспортування хворого для проведення первинного ПКВ у найближчі 120 хв) — районна лікарня.
1. Хворий з ГКС госпіталізується виключно до відділення кардіологічного профілю з наявністю блоку реанімації та інтенсивної терапії чи реанімаційного відділення.
2. Проведення тромболітичної терапії за наявності показань і відсутності протипоказань згідно з протоколом тромболітичної терапії. Часовий проміжок між потраплянням хворого до стаціонару і початком тромболітичної терапії не повинен перевищувати 30 хв («двері — голка»).
3. Вирішення питання про транспортування хворого до стаціонару з наявністю ангіографічного обладнання та умов для ПКВ. У разі успішного клінічного тромболізису також є доцільним проведення діагностичної ангіографії у перші 24 год від початку захворювання (але не раніше ніж через 2 год після закінчення тромболітичної терапії, якщо немає показань для негайного проведення ангіографії — посилення болю, ознак лівошлуночкової недостатності, негативної динаміки на ЕКГ тощо).
4. Планове призначення антитромбоцитарних препаратів (АСК + клопідогрель), антикоагулянтів (стандартний гепарин або еноксапарин, або фондопаринукс), ББА, іАПФ/БРА, статинів.
Третинний етап
Стаціонар з лабораторією (відділенням) інтенсивної кардіології.
1. Проведення первинного коронарного втручання у хворих з наявністю показань (з персистуючою елевацією сегмента ST, больовим синдромом) необхідне якомога раніше від моменту госпіталізації, але протягом перших 24 год захворювання.
2. Часовий проміжок між потраплянням хворого до стаціонару і відкриттям інфарктзалежної судини не повинен перевищувати 90 хв.
3. Якщо хворий транспортований зі стаціонару без ангіографічної підтримки, загальний час від першого лікарського огляду пацієнта до відкриття інфарктзалежної судини не повинен перевищувати 120 хв.
4. Забезпечення своєчасного проведення «ПКВ порятунку» у хворих з неефективним тромболізисом, який проводиться на етапах госпіталізації (або в лікарні, з якої пацієнт переведений для проведення «ПКВ порятунку»).
5. У разі неінвазивних ознак ефективної фібринолітичної терапії у стабільних пацієнтів необхідно визначати час проведення діагностичної коронарографії з метою вирішення питання про подальшу реваскуляризацію міокарда (бажано протягом перших 24 год).
6. Забезпечення стандартної терапії антитромбоцитарними препаратами (АСК + тікагрелор або АСК + клопідогрель), антикоагулянтами (стандартний гепарин або еноксапарин, або фондапаринукс), ББА, іАПФ/БРА, статинами.
Перелік фармакологічних препаратів для лікування при ГКС з елевацією сегмента ST та його можливих ускладнень
Для закладів, які надають екстрену медичну допомогу:
- 1. Нітрати: нітрогліцерин.
- 2. Антиагреганти: АСК, тікагрелор, клопідогрель.
- 3. Антикоагулянти: гепарин, еноксапарин.
- 4. ББА: есмолол, метопролол, пропранолол, карведилол.
- 5. Адреноміметичні лікарські засоби: добутамін, допамін, норепінефрин.
- 6. Наркотичні анальгетики: морфін, тримеперидин.
- 7. Анксіолітики: діазепам.
- 8. Ненаркотичні анальгетики: метамізол натрію.
- 9. Кровозамінники та перфузійні розчини: натрію хлорид, глюкоза.
Для закладів, які надають первинну медичну допомогу:
- 1. Нітрати: нітрогліцерин.
- 2. Антиагреганти: АСК, клопідогрель, тікагрелор.
- 3. Антикоагулянти: гепарин.
- 4. ББА: пропранолол, метопролол, карведилол.
- 5. Наркотичні анальгетики: морфін, тримеперидин.
- 6. Анксіолітики: діазепам.
- 7. Ненаркотичні анальгетики: метамізол натрію.
- 8. Кровозамінники та перфузійні розчини: натрію хлорид, глюкоза.
Для закладів, які надають вторинну (і третинну) медичну допомогу:
- 1. Нітрати: нітрогліцерин, ізосорбіду динітрат.
- 2. Антиагреганти: АСК, тікагрелор, клопідогрель, ептифібатид.
- 3. Антикоагулянти: гепарин, еноксапарин, фондапаринукс, варфарин.
- 4. Фібринолітики: алтеплаза, стрептокіназа, тенектеплаза.
- 5. ББА: метопролол, пропранолол, карведилол.
- 6. Адреноміметичні лікарські засоби: допамін, добутамін, норепінефрин.
- 7. БРА: валсартан.
- 8. іАПФ: каптоприл, лізиноприл, раміприл, периндоприл, зофенаприл.
- 9. ААП: атропін, лідокаїн, аміодарон.
- 10. АК: дилтіазем, верапаміл, амлодипін.
- 11. Неглікозидні кардіотонічні засоби: левосимендан.
- 12. АМР: спіронолактон, еплеренон.
- 13. Петльові діуретики: фуросемід, торасемід.
- 14. Інгібітори ГМГ-КоА-редуктази чи статини: аторвастатин, розувастатин.
- 15. Наркотичні анальгетики: морфін.
- 16. Анксіолітики: діазепам.
- 17. Ненаркотичні анальгетики: метамізол натрію.
- 18. Кровозамінники та перфузійні розчини: натрію хлорид, глюкоза.
- 19. ІПП: пантапрозол, рабепразол.
Інтервенційні та хірургічні методи лікування
Ці методи застосовуються у спеціалізованих відділеннях згідно з вищеописаним порядком. Технічні аспекти ПКВ у пацієнтів з ГКС з елевацією сегмента ST (тромболітична оклюзія чи критичне звуження інфарктзалежної КА) мають лікуватися з використанням перкутанних втручань (ангіопластика, стентування). За наявності необхідного обладнання та матеріалів прохідність інфарктзалежної КА відновлюють стентуванням (яке має переваги над балонною ангіопластикою при проведенні первинного ПКВ) (табл. 2.34).
Можливе проведення ПКВ тільки в інфарктзалежній судині, за винятком кардіогенного шоку та випадків, коли після ПКВ інфарктзалежної артерії активна ішемія виникає в зоні кровопостачання артерій, не пов’язаних з ІМ. У разі, якщо з анатомічних або клінічних причин проведення перкутанного втручання неможливе, пацієнту показане проведення прямого хірургічного втручання (АКШ).
| Рекомендації | Клас рекомендацій | Рівень доказовості |
| Реперфузійна терапія показана всім пацієнтам із симптомами ішемії тривалістю 12 год та персистентним підйомом сегмента SТ | І | A |
| При дотриманні встановлених часових інтервалів необхідно вибирати стратегію ПКВ, а не тромболізис | І | A |
| Якщо ПКВ не може бути виконане у визначені часові інтервали після встановлення діагнозу SТЕМІ, рекомендоване проведення тромболізису впродовж 12 год від початку симптомів, за відсутності протипоказань | І | А |
| У разі відсутності підйому сегмента SТ, ПКВ показане пацієнтам із підозрою на персистентні ішемічні симптоми, що вказують на IМ, і за наявності як мінімум одного з таких критеріїв: гемодинамічна нестабільність або кардіогенний шок; біль у грудях, що рецидивує або зберігається і є рефрактерним до медикаментозної терапії; загрозлива для життя аритмія чи зупинка серця; механічні ускладнення IМ; гостра СН; повторні динамічні зміни сегмента SТ або зубця Т, особливо рецидивна елевація сегмента SТ | І | С |
| Проведення ранньої коронароангіографії (у найближчі 24 год) показане у разі повного регресу симптомів та нормалізації сегмента SТ — спонтанно чи на тлі застосування нітрогліцерину (за умови відсутності повторення симптомів або виникнення нової елевації сегмента SТ) | І | С |
| Пацієнтам із виникненням SТЕМІ >12 год показана стратегія первинного ПКВ при збереженні симптомів ішемії, за гемодинамічної нестабільності, загрозливих для життя порушень ритму | І | С |
| Рутинна стратегія первинного ПКВ повинна бути розглянута в пацієнтів із запізнілою госпіталізацією — 12–48 год від початку симптомів SТЕМI | IIa | B |
| У безсимптомних пацієнтів рутинне ПКВ на оклюзованій інфарктзалежній артерії не показане, якщо минуло >48 год від розвитку SТЕМІ | III | A |
Антитромбоцитарна терапія хворих після проведення планових ПКВ
1. Усі пацієнти після коронарного стентування повинні отримувати подвійну антитромбоцитарну терапію.
2. Подвійна антитромбоцитарна терапія призначається до або під час проведення ПКВ, включає прийом препаратів АСК та клопідогрелю. Початкова (навантажувальна) доза АСК становить 150–300 мг (або 80–150 мг в/в) з подальшим прийомом 75–100 мг щодня; початкова (навантажувальна) доза клопідогрелю — 300–600 мг з подальшим прийомом 75 мг щодня.
3. Рекомендується лікування клопідогрелем дозою 600 мг (навантажувальна доза) для пацієнтів, яким планується проведення ПКВ, якщо відома анатомія коронарних судин, і рішення про проведення ПКВ приймається за >2 год перед процедурою.
4. У пацієнтів високого ризику тромботичних ускладнень після проведення стентування можна призначити посилену антитромбоцитарну терапію: 150 мг клопідогрелю (замість 75 мг) на фоні прийому АСК (75–100 мг) протягом 7 днів з подальшим переходом до стандартних доз.
5. У хворих, які приймають підтримувальну дозу клопідогрелю 75 мг, можна розглядати можливість застосування навантажувальної дози 300 мг відразу після підтвердження показань до проведення ПКВ.
6. Подвійну антитромбоцитарну терапію призначають як мінімум на 1 міс після імплантації ВМS.
7. Подвійну антитромбоцитарну терапію призначають як мінімум на 6 міс після імплантації DES другого і третього покоління.
8. Менша тривалість подвійної антиагрегантної терапії (<6 міс) може розглядатися після імплантації DES другого і третього покоління в осіб з високим ризиком розвитку кровотечі й низьким ризиком розвитку ішемічних ускладнень.
9. Більша тривалість подвійної антитромбоцитарної терапії (>6 міс) може розглядатися після імплантації DES (другого і третього покоління) у пацієнтів з високим ризиком розвитку ішемічних ускладнень і низьким ризиком кровотечі.
У разі виявлення складного багатосудинного ураження КА необхідно своєчасно вибрати оптимальну для кожного пацієнта стратегію реваскуляризації (ПКВ/АКШ), враховуючи клінічний стан хворого, вираженість та поширеність коронарного атеросклерозу, характеристики уражень. Шкала оцінювання SYNTAX пропонує доволі точне прогнозування смерті, ІМ та реваскуляризації ураженої судини. Необхідно пам’ятати, що шкала SYNTAX розрахована на використання стентів із лікарським покриттям.
Зупинимося на особливостях реваскуляризації міокарда у жінок при ІМ (АНА, 2016) (табл. 2.35).
| Вид РМ | РМ при IMпST |
| ТЛТ | Підвищений ризик смертності та кровотеч порівняно з ПКВ. Використання в лікарнях, де неможливо провести ПКВ (при затримці проведення ПКВ >120 хв від першого медичного контакту). Відсутні конкретні рекомендації щодо вибору препарату залежно від статі пацієнта |
| АКШ | Жінки мають підвищений ризик внутрішньолікарняної смерті порівняно з чоловіками. Рекомендації залежно від статі відсутні |
| ПКВ | Зниження смертності та ризиків рецидиву ІМ при використанні ранньої інвазивної стратегії у жінок високого ризику. Жінки з факторами високого ризику повинні отримувати лікування відповідно до ранньої інвазивної стратегії |
Примітка. ТЛТ — тромболітична терапія.
Лікувальна тактика гострого ІМ
Необхідні дії керівника бригади екстреної (швидкої) медичної допомоги [60]
Обов’язкові дії:
1. Положення пацієнта лежачи зі злегка піднятою головою. Хворим на гострий ІМ для зменшення навантаження на міокард необхідно обмежити фізичне навантаження, забезпечити повний психологічний спокій, не дозволяти пацієнту самостійно пересуватися.
2. Проведення оксигенотерапії показане пацієнтам зі зниженням сатурації ˂90%. Інгаляцію зволоженим киснем проводити за допомогою маски або через носовий катетер зі швидкістю 3–5 л/хв.
3. Забезпечення венозного доступу.
Усім пацієнтам з гострим ІМ у перші години захворювання або у разі виникнення ускладнень показана катетеризація периферичної вени. Венозний доступ проводиться шляхом виконання стандартної процедури венозної пункції з дотриманням заходів асептики/антисептики катетером для в/в пункції, який ретельно фіксується пов’язкою.
Обґрунтування. Підйом сегмента ST свідчить про гостру оклюзію КА та ішемію міокарда, тому відновлення кровообігу за рахунок усунення тромбу і відновлення просвіту КА має вирішальне значення для перебігу захворювання.
Показання для проведення коронарографії хворим із ГКС
Ургентна коронарографія:
- Елевація сегмента ST на ≥1 мм у двох суміжних стандартних відведеннях ЕКГ чи на ≥2 мм у двох суміжних грудних відведеннях ЕКГ в перші 24 год від моменту розвитку больового синдрому; БЛНПГ, що гостро виникла.
- Справжній кардіогенний шок з підйомом сегмента ST за першої можливості від моменту захворювання та бажано протягом 1 год від розвитку шоку.
Невідкладна коронарографія:
- Рецидивуючий больовий синдром у пацієнтів із ІМ в перші 24 год захворювання незалежно від глибини та локалізації ураження.
- Розвиток постінфарктної стенокардії у строки >72 год від початку ІМ.
Планову коронарографію проводять:
- за наявності об’єктивних ознак ішемії (транзиторні зміни ішемічного характеру, зареєстровані на ЕКГ у спокої чи за результатами добового моніторування ЕКГ, або позитивний результат навантажувального тесту);
- за соціальними показаннями при мінімальних проявах та нечітких ознаках ішемії, якщо професія хворого пов’язана з ризиком для життя інших людей (пілоти, водії), бойовими чергуваннями;
- у хворих після трансплантації серця (загальноприйнятий протокол передбачає щорічне проведення коронарографії);
- перед операціями на клапанах серця у хворих віком старше 40 років;
- при проведенні диференційної діагностики з некоронарогенними захворюваннями міокарда (атиповий больовий синдром, ГКМП чи дилатаційна кардіоміопатія (ДКМП) та ін.);
- пацієнтам з безсимптомним або малосимптомним перебігом ІХС, проте з результатами неінвазивних досліджень, що відносять до факторів ризику несприятливого прогнозу.
Абсолютних протипоказань до проведення коронарографії немає. Відносні протипоказання такі:
- гостра ниркова недостатність чи ХНН;
- шлунково-кишкові кровотечі;
- виражена анемія чи коагулопатія;
- гостре порушення мозкового кровообігу;
- задокументований анафілактичний шок на контраст в анамнезі;
- відмова хворого від можливого подальшого лікування (ТБКА, АКШ);
- виражене ураження периферичних артерій, що обмежує артеріальний доступ;
- декомпенсована СН, набряк легень;
- злоякісна АГ;
- інтоксикація серцевими глікозидами;
- значні порушення електролітного обміну;
- лихоманка невідомого генезу та гострі інфекційні захворювання;
- інфекційний ендокардит;
- загострення хронічного некардіального захворювання;
- полівалентна алергія.
Згідно зі стандартами хворі, яким планується проведення коронарографії, повинні бути ретельно обстежені. Необхідно зібрати скарги та анамнез, уточнити достовірність ангінозного синдрому, визначити ФК стенокардії, ознаки дестабілізації, анамнез життя та захворювання (фактори ризику, ЦД, ознаки атеросклерозу іншої локалізації, тромбофлебіт, алергія, перенесені інфаркти чи інсульти тощо).
Лабораторне обстеження має включати клінічний аналіз та біохімію крові (вміст калію, натрію, креатиніну, сечовини, активність АлАТ, коагулограма, група крові, резус-фактор).
Хворим перед коронарографією слід провести ЕКГ, ехоКГ (з оцінкою розмірів серця, регіональної та загальної скоротливості, ФВ, стану клапанів), холтерівське моніторування ЕКГ (ознаки ішемії, порушення ритму і провідності), рентген органів грудної порожнини, допплер-дослідження підключично-сонного та клубово-стегнових сегментів артерії.
Важливо пам’ятати про заходи, яких не варто вживати при ІМ згідно з рекомендаціями доказової медицини (табл. 2.36).
| Заходи | Клінічні рекомендації | Рівень доказовості |
| Стрес-тест | Не показаний протягом 2–3-го дня ІМ, якщо не досягнуто успішної реперфузії | С |
| Не показаний при ранній постінфарктній стенокардії, ХСН, життєзагрозливих аритміях, наявності протипоказань | С | |
| Не використовують для стратифікації ризику у пацієнтів з ІМ, яким планується коронарографія | С | |
| Визначення маркерів некрозу міокарда | Не слід затримувати початок реперфузійної терапії у зв’язку з відсутністю результатів загального аналізу крові, біохімічного аналізу крові, коагулограми; необхідно повторно визначити маркери некрозу міокарда для діагностики реінфаркту протягом перших 18 год від початку ІМ | С |
| ЕхоКГ | Не показано як рутинне дослідження для повторної оцінки пацієнта з ІМ без будь-якої динаміки у клінічному стані чи протягом реваскуляризації | С |
| Діагностична коронарографія | Не показана хворим, яким не планують втручання на КА | С |
| Не показана після 12 год від початку ІМ хворим на фоні стабільної гемодинаміки | С | |
| Інвазивне моніторування показників тиску в легеневій артерії (катетеризація легеневої артерії) | Не показане хворим без ознак нестабільності гемодинаміки і легеневої недостатності | С |
Протипоказані та не рекомендовані втручання пацієнтам з гострим ІМ:
1. Не слід застосовувати для знеболення комбінацію метамізолу натрію з дифенгідраміном.
2. Протипоказане введення лікарських засобів внутрішньом’язово (в/м), оскільки це унеможливлює в майбутньому проведення тромболізису та спричиняє хибний результат при визначенні рівня КФК.
3. Протипоказане профілактичне застосування лідокаїну (ризик виникнення блокад серця).
4. Протипоказане застосування атропіну для профілактики вагусних ефектів морфіну, оскільки підвищення ЧСС може поглибити ішемію міокарда, спричинити порушення ритму.
5. Протипоказане застосування дипіридамолу, міотропних спазмолітиків (спричиняє синдром обкрадання).
6. Протипоказані антикоагулянти на фоні гіпертензивних кризів (ризик крововиливів та кровотечі).
Особливості лікування при гострому ІМ згідно з рекомендаціями доказової медицини:
1. При гострому ІМ основним методом патогенетичного лікування є реваскуляризація міокарда, а у разі неможливості її проведення — тромболітична терапія.
2. Під впливом тромболітиків зниження ризику смерті відзначають за будь-якої локалізації ІМ, але він суттєво знижується при локалізації ІМ в передній стінці. Однак тромболітики не лише розчиняють тромб — їм притаманна також парадоксальна дія (підвищують вміст тромбіну, фібрину, тромбоксану, підвищують агрегацію тромбоцитів і згортання крові), що сприяє розвитку ретромбозу (!). Тому з метою профілактики ретромбозу (який найбільше викликає стрептокіназа і меншою мірою — тканинний активатор плазміногену) вводять гепарин чи еноксапарин. Доведено, що тромболітики ІІ покоління (тканинний активатор плазміногену, алтеплаза) менше викликають побічні реакції, діють швидше, але вони частіше, ніж стрептокіназа, спричиняють різні кровотечі та інсульти. При ІМ тромболітики ефективніші, ніж фібринолітики. Максимальний терапевтичний ефект тромболітиків при ІМ настає через 3 год. Час від моменту госпіталізації хворого до проведення тромболітичної терапії має становити 30 хв. Узагальнююча схема застосування тромболітиків при ІМ наведена в табл. 2.37.
| Препарат | Дозування | Допоміжна терапія |
| Стрептокіназа | 1 500 000 ОД в/в протягом 1 год | АСК. Еноксапарин |
| Тканинний активатор плазміногену (алтеплаза) | 15 мг болюсно, потім — 50 мг в/в протягом наступних 30 хв та 35 мг в/в протягом 60 хв | АСК. Еноксапарин |
| Тканинний активатор плазміногену (алтеплаза) — пацієнту з масою тіла <65 кг | Загальна доза — 1,25 мг/кг: 10% дози — в/в болюсно, решта дози — в/в протягом наступних 3 год | АСК. Еноксапарин |
| Тенектеплаза | В/в болюсно одномоментно, залежно від маси тіла: <60 кг — 30 мг; 60–70 кг — 35 мг; 71–80 кг — 40 мг; 81–90 кг — 45 мг; >90 кг — 50 мг | АСК. Еноксапарин |
Примітка. Наведені лише препарати, схвалені в США (FDA), Україні, та їхні аналоги.
Пацієнти з ІМ без ознак ішемії, симптомів СН і тяжких аритмій не повинні перебувати на ліжковому режимі більше 12–24 год (ІІІ, С).
Протипоказання до призначення тромболітичної терапії хворим на ІМ
Абсолютні протипоказання:
- будь-яка внутрішньочерепна кровотеча в анамнезі;
- структурні ураження судин мозку (аномалії розвитку);
- злоякісні новоутворення головного мозку (первинні та метастатичні);
- ішемічний інсульт протягом останніх 3 міс, за винятком транзиторної ішемічної атаки тривалістю до 3 год;
- активні кровотечі або геморагічний діатез (окрім менструації);
- закрита черепна травма чи травма обличчя в останні 3 міс.
Відносні протипоказання:
- хронічна тяжка неконтрольована АГ в анамнезі;
- неконтрольована АГ на момент госпіталізації (САТ >180 мм рт. ст. або ДАТ >110 мм рт. ст.) — це може бути абсолютним протипоказанням у пацієнтів з ІМ низького ризику;
- ішемічний інсульт в анамнезі (тривалістю >3 міс), деменція чи інша внутрішньочерепна патологія;
- травматична або тривала (>10 хв) серцево-легенева реанімація, або серйозна хірургічна операція (до 3 тиж);
- недавня (протягом 2–4 тиж) внутрішня кровотеча;
- пункція судини, яку не можна притискати;
- вагітність;
- прийом антикоагулянтів у даний момент, коли міжнародне нормалізоване відношення (МНВ) підвищене, що є фактором ризику кровотеч;
- пептична виразка шлунка чи дванадцятипалої кишки в активній стадії.
Кровотечі при ГКС — найчастіші неішемічні ускладнення, що виникають під час лікування при ГКС без елевації сегмента ST. Багатьма дослідженнями підтверджено прямий взаємозв’язок між кровотечею та ризиком смерті чи інших ішемічних подій.
Профілактика кровотеч стала настільки ж важливою, як і профілактика ішемічних подій, тому оцінка ризику в пацієнтів із ГКС повинна враховувати ймовірність виникнення обох цих ускладнень. Профілактика кровотеч включає вибір безпечних препаратів, їх правильне дозування (з урахуванням віку, статі, КК), зменшення тривалості антитромботичного лікування, використання комбінації антитромботичних і антиагрегантних препаратів за показаннями, вибір радіального, замість стегнового, доступу при використанні інвазивної стратегії.
Тактика ведення пацієнтів з ГКС без елевації сегмента ST залежно від ризику виникнення кровотеч
Пацієнтам із високим ризиком кровотеч показані препарати, комбінації препаратів та процедури (судинне втручання), які мають нижчий ризик кровотеч.
У разі значних кровотеч показане переривання та нейтралізація антикоагулянтної та антитромбоцитарної терапії, окрім випадків, якщо кровотеча може бути контрольована певними гемостатичними заходами.
Малі кровотечі мають бути усунені переважно без переривання активного лікування.
Переривання антикоагулянтної терапії та її нейтралізацію шляхом трансфузії тромбоцитів здійснюють залежно від препарату і тяжкості кровотеч.
Переливання крові може мати негативний ефект, тому показане лише після індивідуальної оцінки, але не рекомендоване у гемодинамічно стабільних пацієнтів із гематокритом >25% або рівнем гемоглобіну >7 г/л.
Еритропоетин не показаний у разі анемії чи втрати крові.
Особливості застосування медикаментозних засобів при ІМ:
- Переконливо доведено, що НФГ чи НМГ слід обов’язково призначати при гострому ІМ без підйому сегмента ST.
- При гострому ІМ одним із перших призначають АСК у дозі 325 мг/добу, а в підгострий період — по 75–100–150 мг/добу. Пацієнтам з гострим ІМ без зубця Q показане застосування комбінації АСК в низьких дозах і клопідогрелю.
- ББА при гострому ІМ знижують розвиток ускладнень, летальність, ризик розривів серця, раптової зупинки кровообігу. Найефективніша ББА дія спостерігається при поширеному ІМ у пацієнтів віком старше 65 років. Однак в останні роки при гострому ІМ рекомендується надавати перевагу реваскуляризації серця, а ББА призначають для антиішемічної, антиадренергічної та антифібриляторної дії. При гострому ІМ вони знижують летальність, РСС. У хворих на ІМ з дисфункцією ЛШ ББА комбінують з іАПФ і нітратами. За даними Національного реєстру США, застосування ББА у хворих, які отримували тканинний активатор плазміногену, знижує розвиток геморагічних інсультів. Не слід призначати ББА з внутрішньою симпатоміметичною активністю, оскільки їхня ефективність не доведена.
- Нітрогліцерин в інфузіях при гострому ІМ не знижує летальності, і його вводять лише при рецидивуючому больовому синдромі та ГЛШН.
- АК при ІМ з дисфункцією серця не призначають за невеликим винятком, коли хворі не переносять ББА. Після прийому короткодіючого ніфедипіну можливий летальний кінець (!).
- Застосування іАПФ при гострому ІМ — це нововведення в терапії, спрямоване на запобігання розвитку гострого ремоделювання серця. Їх призначають одразу або через 2 доби від початку розвитку ІМ, коли стабілізувався АТ. Під їхнім впливом знижується летальність і розвиток злоякісних шлуночкових порушень ритму серця. Найдоцільніше застосовувати їх при лівошлуночковій недостатності ІІ–ІІІ ФК за Killip, ЧСС >100 уд./хв, передній локалізації ІМ та ХСН. У разі непереносимості іАПФ їх можна заміняти БРА.
- При гострому ІМ з дисфункцією ЛШ і СН допоміжне застосування селективного блокатора рецепторів альдостерону еплеренону в дозі 25–50 мг/добу на тлі стандартної терапії знижувало загальну смертність, смертність від ССЗ і частоту госпіталізацій (EPHESUS, 2003).
- Результати метааналізу 11 досліджень (2646 хворих) при гострому ІМ свідчать, що застосування глюкокортикоїдів (ГК) може знижувати смертність; в жодному дослідженні не виявлено переконливих доказів того, що ГК негативно впливають на перебіг гострого ІМ. Їх застосовують при кардіогенному шоку.
- У РКД MAGІС солі магнію при гострому ІМ були неефективними у зниженні летальності, проте їх слід вводити при ШТ на фоні подовження інтервалу Q–T.
- Суперечливі результати РКД не дозволяють рекомендувати глюкозоінсулін-калієву суміш у перші 48 год гострого ІМ (за винятком хворих на ІМ у поєднанні з ЦД). Схему лікування ІМ в гострий період наведено в алгоритмі 2.11.
| Алгоритм 2.11. Надання невідкладної допомоги при ІМ в гострій стадії в умовах стаціонару Купірування больового синдрому та оксигенотерапія: 1. Нітрогліцерин під язик у таблетках (0,5–1 мг), в аерозолі (1–2 дози або 0,4–0,8 мг). У разі необхідності та при нормальному рівні АТ повторювати прийом кожні 5–10 хв. 2. Морфін по 0,2–0,4 мл 1% розчину (2–4 мг) із повторним введенням таких болюсів через 5–15 хв (морфін у високих дозах викликає гіпотонію, пригнічення дихання, блювання, особливо в осіб похилого віку; при поєднанні морфіну з нітрогліцерином підвищується ризик смерті) [37]. Морфіну притаманна власна антиішемічна дія; він спричиняє дилатацію вен, знижує переднавантаження та зменшує потребу міокарда в кисні. Контроль та корекція АТ: Обов’язкові дії: 1. Рекомендований контроль рівня АТ. 2. Низький рівень АТ погіршує кровообіг у коронарних судинах, що призводить до збільшення зони інфаркту та є предиктором електричної нестабільності міокарда. 3. Для підвищення АТ перевага надається в/в крапельному введенню допаміну зі швидкістю 2–10 мкг/кг/хв під контролем ЧСС та АТ, що може поєднуватися з в/в крапельним введенням добутаміну, починаючи з дози 2,5–5 мкг/кг/хв. 4. Навпаки, при високому АТ для його зниження застосовують ББА і/або нітрати. Відновлення магістрального коронарного кровотоку за допомогою одного із тромболітиків: 1. Стрептокіназа — по 1–1,5 млн ОД в/в. 2. Тканинний активатор плазміногену (алтеплаза) по 15 мг болюсно, потім — по 50 мг за 30 хв, 35 мг за 1 год в/в. 3. Тенектеплаза 30–50 мг (0,5 мг/кг) в/в болюсно. Основним показанням до введення тромболітиків є підйом сегмента ST у ≥2 суміжних відведеннях чи повна БЛНПГ у перші 12 год від початку появи симптомів (госпітальна летальність знижується більше ніж удвічі). Якщо у пацієнта ішемічні зміни на ЕКГ тривають >12 год, тромболітична терапія застосовується у термін до 24 год від початку їх виникнення. В Українських та Європейських рекомендаціях (2014) тромболітики належать до засобів першої лікарської допомоги. Хворим, яким протипоказане введення тромболітиків, проводиться екстрена коронароангіографія та стентування КА. Запобігання подальшому тромбоутворенню (ретромбозу): 1. НФГ по 1400 ОД/год або 60 ОД/кг в/в, п/ш (не більше 4000 ОД) з подальшою інфузією 12 ОД/кг (але не більше 1000 ОД/год) під контролем AЧTЧ, який повинен збільшуватись у 1,5–2 рази (цільовий рівень — 50–70 с), що визначають через кожні 6 год після введення НФГ. НФГ потрібно вводити при застосуванні неселективних тромболітиків (стрептокіназа, алтеплаза) при високому ризику тромбоемболій (передньому ІМ, ФШ, тромбоемболії в анамнезі). При ГКС без елевації сегмента ST НФГ необхідно вводити протягом 48 год, НМГ (еноксапарин, фондапаринукс) — до 8 діб. Гепарин при в/в введенні знижує смертність, зменшує розвиток тромбозів ЛШ та інсультів, що доведено даними РКД. 2. НМГ еноксапарин призначають по 0,6 мл п/ш пацієнтам віком до 75 років. Прямі антикоагулянти знижують частоту реоклюзії, рецидивів ІМ чи нестабільної ранньої післяінфарктної стенокардії. Фондапаринукс. Якщо рівень креатиніну в сироватці крові ˂2,5 мг/дл, то в/в болюс становить 2,5 мг 1 раз на добу протягом госпітального періоду, але не більше 8 діб. Еноксапарин. Для пацієнтів віком до 75 років: в/в болюс становить 30 мг; через 15 хв — п/ш ін’єкція 1 мг/кг (повторювати кожні 12 год протягом госпітального періоду, але не більше 8 діб). Виконувати ці рекомендації, якщо рівень креатиніну в сироватці крові становить ˂2,5 мг/дл у чоловіків або ˂2,3 мг/дл — у жінок, або КК >30 мл/хв. Для пацієнтів віком старше 75 років: п/ш ін’єкція 0,75 мг/кг (повторювати кожні 12 год протягом госпітального періоду, але не більше 8 діб). Якщо КК протягом лікування становить ˂30 мл/хв, то рекомендована доза — 1 мг п/ш 1 раз на добу. 3. АСК спочатку слід дати розжувати 300 мг, а потім по 75–100–150 мг/добу (комбіноване застосування АСК і тромболітика — золотий стандарт при лікуванні ІМ з підйомом сегмента SТ), що знижує ризик розвитку стенозів КА в майбутньому. АСК комбінують також із клопідогрелем — спочатку 300 мг, а потім — 75 мг/добу. ПКВ проводять у спеціалізованому відділенні (центрі). Якщо загальний час з моменту початку болю в серці до транспортування хворого до лікарні може перевищити 60–90 хв, слід вирішити питання про догоспітальний тромболізис із подальшим транспортуванням пацієнта до спеціалізованого структурного підрозділу з метою проведення ургентної коронарографії та за необхідності коронарного стентування в першу добу від початку симптомів гострого ІМ. Якщо загальний час з моменту початку больового нападу становить >90 хв, а час транспортування до центру (відділення) займає не більше 120 хв, пацієнт повинен транспортуватися до найближчого спеціалізованого структурного підрозділу для проведення ургентної коронарографії та первинного стентування КА без попереднього тромболізису. Запобігання гострому ремоделюванню серця та обмеження периінфарктної зони: 1. Нітрогліцерин 2 мл 1% розчину чи нітрогліцерин 10 мг, чи нітрогліцерин 25–50 мг, чи ізосорбіду динітрат 10 мг в/в (обмежує периінфарктну зону при САТ >90 мм рт. ст. або при зниженні його на більше ніж 30 мм рт. ст.). В/в введення нітрогліцерину показане в перші 48 год ІМ для усунення ішемії міокарда (ефективність його не доведена); прийом пролонгованих нітратів після перенесеного ІМ недоцільний, оскільки не зменшує кінцевих точок (!). 2. ІАПФ через 48 год: каптоприл 50–75 мг/добу чи еналаприл 10–20 мг/добу, чи раміприл 5–10 мг/добу (запобігає гострому ремоделюванню серця). 3. Післяінфарктну зону зменшують також тромболітики, антикоагулянти, ББА, нітрати. Запобігання розвитку небезпечних аритмій серця одним із ББА (призначається усім хворим, якщо немає протипоказань): метопрололу сукцинат — по 50–100 мг/добу; пропранолол — по 20–40 мг 3 рази на добу; бісопролол — по 5–10 мг/добу; есмолол — 25–50 мкг/кг/хв; карведилол — по 25–50 мг/добу; магнію сульфат — по 10 мл 25% розчину при «пірует»-тахікардії та гіпомагніємії; лідокаїн призначати для профілактики шлуночкових аритмій не можна, оскільки він підвищує смертність за рахунок розвитку блокад та асистолії, а при ШТ і шлуночкових екстрасистолах застосовувати його доцільно, при поліморфній ШТ — ні. Раннє застосування статинів: Цільовий рівень загального ХС становить 4,0 ммоль/л, ХС ЛПНЩ < 2,5 ммоль/л. |
Для лікування ІМ використовують дві групи тромболітиків:
1) не споріднені з фібрином (стрептокіназа, АПСАК — анізольований плазміногенстрептокіназний активований комплекс), що сприяють системному фібринолізу;
2) споріднені з фібрином тромбу (алтеплаза, тканинний активатор плазміногену).
Усі заходи проводять швидко. Нітрогліцерин, іАПФ, ББА застосовують лише при САТ, що становить ≥90–100 мм рт. ст. При низькому АТ ці препарати необхідно застосовувати під захистом симпатоміметиків допаміну, добутаміну.
При в/в введенні стрептокінази реперфузія розпочинається через 45 хв. Відновлення коронарного кровообігу відбувається у 60–70% пацієнтів. Ознаками успішного тромболізису у хворих на ІМ є припинення болю, швидка динаміка ЕКГ — значне зниження сегмента ST (на 50%) і повторне підвищення активності КФК (чи КФК-МВ) приблизно через 1,5 год після введення стрептокінази. У цих пацієнтів можуть виникати реперфузійні аритмії — частіша поява шлуночкових екстрасистол чи прискореного ідіовентрикулярного ритму, а інколи — підвищення частоти виникнення ШТ і ФШ. У разі необхідності проводять лікувальні заходи в повному обсязі. Однак зазначимо, що ранню реоклюзію відзначають у 10–30% хворих.
Найзначнішим досягненням у медикаментозному лікуванні при ІМ за останні десятиріччя є застосування тромболітиків. Перевагами тромболітичної терапії над інтервенційним лікуванням є проста методика; швидкість реперфузії (через 90 хв — 84% прохідності артерії); відкриття більшої кількості судин і за коротший термін. Таким чином, тромболітична терапія за ефективністю не поступається ангіопластиці КА. Наразі, згідно з рекомендаціями доказової медицини, використовують дві оптимальні терапевтичні схеми застосування тромболітичної терапії: 1) тромболізис у комбінації з ОМТ + еноксапарин + клопідогрель; 2) тромболізис + відкладена ангіопластика КА (від 7 год до 4–28 днів).
Тромболітик алтеплаза (тканинний активатор плазміногену) є золотим стандартом тромболітичної терапії при гострому ІМ. Тенектеплаза за ефективністю аналогічна алтеплазі, спричиняє менше нецеребральних кровотеч, не антигенна, високоспецифічна; застосовується одномоментним введенням з одночасним застосуванням гепарину. У ранній термін лікування при гострому ІМ (до 2 год) перевага надається тромболізису, в пізніший термін — первинній ангіопластиці КА. При кардіогенному шоку тромболітики призначають усім хворим на ІМ віком до 75 років, коли немає протипоказань, а потім їх переводять до відділення, де проводиться катетеризація серця з подальшою реваскуляризацією КА (проведення ТБКА і стентування).
Згідно з рекомендаціями АНА/АСС (2017), тромболітична терапія призначається пацієнтам з гострим ІМ (з підйомом сегмента ST) з часом до 12 год від початку симптомів та підйомом сегмента ST більше ніж на 1 мм принаймні у двох суміжних прекардіальних відведеннях або принаймні у двох сусідніх відведеннях від кінцівок (рівень доказовості А). За відсутності протипоказань тромболітична терапія призначається пацієнтам з гострим ІМ (з елевацією сегмента ST) з часом від початку симптомів до 12 год і новою чи ймовірно гострою БЛПНГ (рівень доказовості А).
Поряд з цим в рекомендаціях АНА/АСС (2007) відзначається, що пацієнтам з ЕКГ-ознаками справжнього заднього ІМ тромболітичну терапію доцільно проводити за відсутності протипоказань (ІІа, С). Якщо у пацієнтів із цими змінами ЕКГ ішемічні симптоми тривають >12 год, тромболітичну терапію доцільно проводити у термін до 24 год від їх виникнення (ІІа, В).
Тромболітичну терапію не слід призначати пацієнтам із депресією сегмента ST на ЕКГ у 12 відведеннях, за винятком хворих із справжнім заднім ІМ (ІІІ, А), а також із симптоматичним перебігом хвороби, якщо симптоми ІМ виникли >24 год тому (ІІІ, С).
Стосовно вищенаведених препаратів необхідно зазначити:
- Нітрогліцерин — по 0,5 мг перорально повинні приймати усі хворі з дискомфортом у грудній клітці, зумовленим ішемією; після прийому трьох таких доз потрібно вирішувати питання про доцільність його застосування в/в.
- ББА при ІМ за відсутності протипоказань призначають усім хворим. Препарати вводять в/в тоді, коли визначається тахікардія чи АГ.
- Антитромботичний препарат АСК призначають у дозі 75–150 мг/добу тривалий час і після виписки пацієнтів зі стаціонару.
У багатоцентрових плацебо-контрольованих дослідженнях, здійснених згідно з рекомендаціями доказової медицини, отримано такі дані:
1. Мегадослідження ІSІS-4, виконане за участю 58 тис. хворих, не підтвердило ефективності сульфату магнію при ІМ.
2. Антиагрегант клопідогрель при ІМ не впливав на виживаність пацієнтів (дослідження СLARІTY-TІM 28, СURE), але цим хворим рідше виконували невідкладні інвазивні процедури. Поряд з цим додавання клопідогрелю до АСК покращує ефективність консервативної терапії хворих на ІМ без суттєвого наростання кровотеч (дослідження СОМІАТ).
3. У пацієнтів із ГКС без елевації сегмента ST допустимо і доцільно одночасно застосовувати антиагрегант клопідогрель із ліпофільними статинами (рекомендації класу ІВ). Тривалість застосування клопідогрелю у цих хворих повинна становити 9–12 міс (мінімум — 14 днів).
4. Доцільність призначення тривалого прийому іАПФ, ББА і аміодарону у хворих із післяінфарктною дисфункцією ЛШ доведено у низці великих рандомізованих досліджень. Покращення прогнозу в цих пацієнтів під впливом іАПФ, ББА при моно- та комбінованій терапії зумовлене обмеженням розвитку патологічного ремоделювання. У пацієнтів із післяінфарктною дисфункцією комбінація іАПФ периндоприлу та ББА метопрололу і особливо карведилолу забезпечує антиремоделюючий ефект. Поєднання периндоприлу з аміодароном і карведилолом зумовлює антиремоделюючий вплив, відновлює систолічну та діастолічну функцію ЛШ.
5. НПЗП селективні (коксиби та ін.) і неселективні (диклофенак тощо), окрім АСК, не можна призначати при гострому ІМ у зв’язку з підвищеним ризиком смерті, ре-ІМ, розриву міокарда та ХСН (рекомендації класу І, рівень доказовості С) (!).
Особливості застосування препаратів при ІМ згідно з рекомендаціями доказової медицини, АНА/АСС:
- при ІМ ББА призначають у перші 24 год, іАПФ та нітрогліцерин — в/в у перші 48 год для зменшення вираженості ішемії, СН, АГ і ремоделювання ЛШ;
- із антитромбоцитарних засобів застосовують АСК у дозі 162–325 мг/добу в першу добу, а потім — 75–150 мг/добу; при гіперчутливості до АСК та виникненні побічних реакцій з боку шлунка краще застосовувати клопідогрель у дозі 75 мг/добу. Після коронарографії та реваскуляризації судин серця клопідогрель застосовують не менше 1 міс;
- НФГ застосовують із розрахунку 60 ОД/кг і не більше 1000 ОД/год;
- у хворих на ІМ при артеріальній гіпотензії проводять внутрішньоаортальну балонну контрапульсацію;
- хворим на ІМ з малим серцевим викидом призначають добутамін, допамін, проводять внутрішньоаортальну балонну контрапульсацію і реваскуляризацію міокарда;
- при застою крові в легенях застосовують морфін, іАПФ (коли АТ >100 мм рт. ст.), переважно короткодіючі (каптоприл — по 6,25 мг 2–3 рази на добу);
- при перевантаженні об’ємом рекомендуються петльові діуретики торасемід, фуросемід тощо;
- хворим з рефрактерним набряком легень корисне проведення внутрішньоаортальної балонної контрапульсації;
- пацієнтам із кардіогенним шоком проводять внутрішньоаортальну балонну контрапульсацію, реваскуляризацію міокарда, стентування КА, АКШ, а за неможливості використати інвазивне втручання — тромболізис;
- при відриві папілярних м’язів, розриві міжшлуночкової перегородки, аневризмі серця проводять АКШ чи аневризмектомію;
- хворим з ФШ і ШТ проводять електроімпульсну терапію (ЕІТ) розрядом 200, потім 300 і 360 Дж, а при рефрактерній ФШ допоміжно вводять аміодарон в/в у дозі 300 мг/добу, після чого дефібриляція ефективніша; необхідна корекція вмісту калію і магнію в крові, а також кислотно-основного стану з метою запобігання виникненню повторних епізодів ФШ;
- при стійкій поліморфній ШТ (триває >30 с з розвитком колапсу) проводять електричну кардіоверсію; при стійкій неускладненій ШТ призначають аміодарон — 150 мг в/в протягом 10 хв із повторним введенням до 360 мг за 6 год (загальна доза не повинна перевищувати 2,2 г/добу);
- одинична і групова шлуночкова екстрасистолія та нестійка ШТ не потребують лікування, якщо вони не супроводжуються гемодинамічними порушеннями;
- для лікування пацієнтів із перикардитом після ІМ рекомендується АСК (за необхідності його доза досягає 650 мг кожні 4–6 год); у разі появи чи збільшення кількості перикардіальної рідини негайно відміняють антикоагулянти; у разі недостатньої ефективності АСК застосовують колхіцин по 0,6 мг перорально кожні 12 год. НПЗП застосовують для зменшення вираженості больового синдрому, а ГК (преднізолон) призначають у разі неефективності попередньої терапії. Ібупрофен застосовувати не рекомендується, оскільки він блокує антитромбоцитарний ефект АСК і може стати причиною вибухання інфарктної «експресії» та сприяти підвищенню тромбоутворення.
Особливості застосування різних препаратів при ІМ наведено в табл. 2.38.
| Препарат | Дозування | Коментарі |
| ААП | ||
| Сірчанокисла магнезія | 1–2 г протягом 1–2 хв або інфузія протягом 8 та 24 год | Необхідний моніторинг серцевого ритму та АТ |
| Аміодарон | Зі швидкістю 15 мг/хв протягом 10 хв, потім — 1 мг протягом 24 год | При рефрактерній ШТ, ФШ, зупинці кровообігу |
| ББА | ||
| Есмолол | Навантажувальна доза — 250 мкг/кг/хв в/в, потім — 25–50 мкг/кг/хв (до максимальної дози 300 мкг/кг/хв) | Дуже короткий період напіввиведення |
| Метопролол | В/в по 5 мг кожні 5 хв 3 рази, потім — перорально по 25–50 мг кожні 12 год | Тривалий період дії; може посилювати прояви СН |
| Пропранолол | В/в 0,1 мг/кг протягом 5 хв, потім — перорально по 20–40 мг кожні 6 год | Тривалий період дії; може поглиблювати прояви СН; відсутність кардіоселективності |
| Інотропні засоби та вазопресори | ||
| Допамін | В/в: початкова доза — 2 мкг/кг/хв; потім — поступова титрація дози | Може поглиблювати ішемію міокарда та посилити застій в малому колі |
| Добутамін | В/в: початкова доза — 2,5 мкг/кг/хв; потім — поступова титрація дози | При підвищенні ЧСС >10% може поглиблюватись ішемія міокарда |
| Норепінефрин | В/в: початкова доза — 2 мкг/кг/хв; потім — поступова титрація дози | Використовують лише у крайніх випадках, як «терапію відчаю» |
| Вазодилататори | ||
| Нітрогліцерин | В/в: початкова доза — 10 мкг/хв; потім — поступова титрація дози | Уникати зниження АТ >10% в осіб із попереднім нормальним АТ і >30% — у пацієнтів з АГ |
| Нітропрусид натрію | В/в: початкова доза — 0,1 мкг/кг/хв; потім — поступова титрація дози | Середня доза — 50–80 мкг/кг/хв |
| Антикоагулянти та антиагреганти | ||
| НФГ | В/в болюсно 5000 ОД, потім — в/в інфузія зі швидкістю 1000 ОД/год (під контролем АЧТЧ) | Менш ефективний, ніж НМГ |
| Еноксапарин натрій | 1 мг/кг п/ш кожні 12 год | Виводиться препарат поступово, не вводять при ХНН |
| Клопідогрель | Навантажувальна доза — 300 мг, потім — по 75 мг 1 раз на добу протягом 1 міс | Можливий розвиток тробоцитопенії та пурпури |
Особливості застосування антитромбоцитарних препаратів при ГКС після ПКВ наведено в табл. 2.39. При ІМ важливо знати ознаки несприятливого прогнозу.
| Антитромбоцитарні препарати | Клас рекомендацій | Рівень доказовості |
| АТТ із застосуванням одного засобу (зазвичай АСК) — для постійного прийому | І | А |
| Подвійна АТТ — щонайменше 1 міс після імплантації непокритого металевого стента | І | А |
| Подвійна АТТ — протягом 6–12 міс після імплантації елютинг-стента 2-го покоління | І | В |
| Подвійна АТТ — >1 року у пацієнтів з високим ризиком ішемічних ускладнень (зокрема тромбоз стента, повторні ГКС за умови застосування подвійної АТТ, дифузне ураження КА), за умови низького ризику кровотеч | ІІb | В |
| Подвійна АТТ — упродовж 1–3 міс у разі високого ризику кровотеч, за потреби невідкладних оперативних втручань чи супутнього лікування із застосуванням препаратів-антикоагулянтів | ІІb | С |
Клінічні ознаки несприятливого прогнозу:
- Похилий вік, жіноча стать, повторний ІМ чи тривала стенокардія в анамнезі, АГ, ЦД, тютюнопаління, а також показники допоміжних досліджень — зниження ФВ ˂40%, неадекватні реакції серцево-судинної системи та проби з фізичним навантаженням, різкі оклюзії судин серця за даними коронарографії. Дуже інформативним є проведення ехоКГ у поєднанні з в/в інфузією добутаміну (з 5 мкг/кг/хв до підвищення ЧСС приблизно на 20 уд./хв) чи до максимальної дози — 40 мкг/кг/хв.
- Фізичні навантаження використовують у всіх пацієнтів. Найбільш безпечним видом фізичного навантаження є ходьба (її розпочинають з 10 хв на день, додаючи по 5 хв щотижня до ≥45 хв 4–5 разів на тиждень). Темп ходьби повинен бути таким, щоб ЧСС під час проведення проби з фізичним навантаженням підвищувалась на 20–30%. Деякі хворі під контролем лікаря можуть використовувати плавання, лижі, велосипед. Фізичні навантаження підвищують фізичну здатність пацієнтів, поріг стенокардії, сприяють нормалізації АТ, покращують показники ліпідного спектра крові, підвищують фібринолітичну активність і, згідно з даними метааналізу РКД, знижують смертність.
Ознаки високого безпосереднього ризику смерті й розвитку ІМ:
- повторні епізоди ішемії міокарда (повторні ангінозні напади в поєднанні та без поєднання з перехідною депресією або елевацією сегмента ST);
- підвищення вмісту серцевих тропонінів Т, І (за неможливості визначення — КФК-МВ у крові);
- гемодинамічна нестабільність (артеріальна гіпотензія, застійна СН);
- пароксизмальні шлуночкові порушення ритму серця (ШТ за типом «пірует», ФШ);
- рання післяінфарктна стенокардія;
- за даними стрес-тесту розвиток ішемії міокарда при низькій толерантності до фізичного навантаження і виражена дисфункція ЛШ (ФВ ˂35% у спокої та при фізичному навантаженні);
- раніше перенесені стентування КА або АКШ.
Ознаки низького безпосереднього ризику смерті та розвитку ІМ:
- відсутність повторних нападів болю у ділянці серця;
- відсутність депресії або елевації сегмента ST, зміни тільки зубця Т (інверсія, зменшення амплітуди) або нормальна ЕКГ;
- відсутність підвищення вмісту серцевих тропонінів Т, І (за неможливості їх визначення — КФК-МВ у крові);
- відсутність тяжких шлуночкових аритмій (ШТ за типом «пірует», ФШ).
Онлайн-калькулятор Acute Coronary Events (www.outcomes-umassmed.org/grace/) дозволяє оцінити ризик летальності та розвитку ІМ як на госпітальному етапі, так і протягом наступного півріччя, а також визначити оптимальний спосіб лікування конкретного хворого. У момент госпіталізації в пацієнта з ГКС без елевації сегмента ST за допомогою цієї шкали оцінюється ризик розвитку найближчого (у процесі госпітального лікування) негативного серцево-судинного кінця (смерть, ІМ) за умови вибору консервативної стратегії лікування.
Фізична реабілітація хворих після перенесеного гострого ІМ в амбулаторних умовах:
- Амбулаторний нагляд (до 7 тиж від розвитку ІМ).
- Адекватність згідно з вимогами контролю за виконанням фізичних навантажень, освоєння дистанційної ходьби зі швидкістю 3–4 км/год, проба з ДФН, проведення медико-соціальної експертизи. Рекомендації щодо виконання побутових і фізичних навантажень, повернення до сімейних обов’язків. На підставі клінічних даних визначення групи ризику для вирішення питання про необхідність реваскуляризації міокарда.
Особливості фізичної реабілітації при ІМ:
- Велоергометрія (на 30-ту добу).
- Якщо спостерігається погана переносимість будь-якого етапу реабілітації, її тривалість збільшується до 2 діб.
- Інколи визначаються ознаки неадекватної реакції серця на фізичний етап реабілітації:
1) виникнення нападів стенокардії;
2) виражена задишка і слабкість;
3) поява порушень ритму і провідності;
4) зниження САТ на ≥10 мм рт. ст.;
5) підвищення ЧСС понад 30 або зниження більше як 10 за 1 хв.
Переносимість фізичного навантаження контролюють за допомогою ЕКГ, відзнятою у 12 відведеннях.
- Після закінчення лікарняного етапу реабілітації хворому бажано провести тестування на велоергометрі або тредмілі. Однак якщо у пацієнта виникає напад стенокардії чи значне (>2 мм) зміщення сегмента ST над або під ізолінією, показана коронарографія з метою проведення ТБКА, стентування чи коронарного шунтування.
У цих пацієнтів проба з ДФН протипоказана при:
- гострому ІМ у перші 10 днів, тяжких ускладненнях ІМ, рецидивах ІМ;
- стенозі стовбура лівої КА >50%;
- ГЛШН;
- розшаруванні аорти, ФП, гострих внутрішньосерцевих і периферичних тромбозах і тромбоемболіях;
- порушеннях мозкового кровообігу давністю до 6 міс, крововиливах у сітківку;
- гемодинамічних значущих вадах серця;
- гострих інфекційних захворюваннях;
- тиреотоксикозі, АГ (АТ >160/100 мм рт. ст. перед проведенням проби);
- значному порушенні опорно-рухового апарату;
- некомпенсованому і тяжкому ЦД;
- ХНН;
- некоригованих електролітних порушеннях;
- психічних розладах.
Фаза одужання включає лікування в кардіологічному санаторії, наприкінці якого пацієнти повинні проходити 2–3 км (за добу — 7–10 км), підніматися на 4–5-й поверх при ЧСС до 120 за 1 хв.
Підтримувальна фаза реабілітації передбачає підтримання фізичних кондицій, підготовку до раціонального працевлаштування, вторинну профілактику ІХС. Контроль за реабілітацією проводить сімейний лікар, а консультує кардіолог.
Детальніша схема комплексу ЛФК при Q-ІМ наведено в табл. 2.40, 2.41.
| № комплексу ЛФК | Час від початку ІМ | Кількість вправ | Положення тіла, види вправ, їх ускладнення в наступних комплексах ЛФК |
| 1, 2а, 2б | 1-й тиждень | 17–18 | Переважно положення лежачи, рухи кистей та стоп, розведення в боки, згинання та розгинання рук і ніг, голови, рухи в суглобах, піднімання та опускання рук, розведення ніг, перехід у положення сидячи, окремі вправи сидячи |
| 3а, 3б | Кінець 1-го–2-й тиждень | 22–25 | Переважно положення сидячи, перехід у положення стоячи, включення вправ із палицею, колові рухи плечима, ногами, нахил і повертання голови, підняття і похитування ніг, перехід у положення стоячи та ходьба по палаті, повертання тіла сидячи та стоячи |
| 4 | 2–3-й тиждень | 28 | Половина вправ у положенні стоячи, ускладнення рухів із палицею, ходьба |
| 5 | 3–6-й тиждень | 29 | Більше половини вправ у положенні стоячи, ходьба, ускладнення рухів із палицею, збільшення нахилів тіла |
| Дні захворювання в умовах стаціонару | Обсяг фізичної активності |
| 3-й | Сидіти на стільці до 10–15 хв |
| 4-й | Сидіти на стільці до 30 хв |
| 5-й | Самостійне миття обличчя, рук, розчісування волосся, гоління, перехід у положення стоячи |
| 7-й | Початок ходьби по палаті, самостійне одягання, роздягання |
| 8–10-й | На 8-й день збільшення дистанційної ходьби; на 10-й день прибирання ліжка |
| 11-й | Миття під ручним душем стоячи |
| 12-й | Початок освоєння сходів, тест із ДФН (за необхідності) |
| 13-й | Збільшення дистанційної ходьби, вихід із приміщення при температурі на вулиці не нижче –10 °С |
| 13–22-й | Продовження збільшення дистанційної ходьби, ходьба по сходах |
Кардіогенний шок
Визначення. Кардіогенний шок — синдром, що виникає внаслідок різкого зниження інотропної, насосної функції серця, що супроводжується неадекватним кровозабезпеченням життєво важливих органів із подальшим порушенням їхньої функції.
У більшості випадків кардіогенний шок виникає в перші години чи перші 1–2 доби від початку ІМ, коли критично знижується насосна функція ЛШ. Частота кардіогенного шоку при Q-ІМ становить 5–8% випадків; він є основною причиною смерті хворих у стаціонарі.
Фактори ризику кардіогенного шоку:
- 1) поширений ІМ передньої стінки ЛШ, площа якого перевищує 40–50% усієї маси шлуночка;
- 2) виражена ішемія міокарда;
- 3) наявність старих рубців після перенесеного ІМ;
- 4) зниження ФВ ЛШ за даними ехоКГ нижче 40%;
- 5) похилий та старечий вік хворого;
- 6) наявність ЦД;
- 7) розрив міжшлуночкової перегородки;
- 8) дисфункція чи розрив папілярних м’язів.
Патогенез. При кардіогенному шоку в результаті розвитку ГЛШН відбуваються такі зміни:
- критичне падіння серцевого викиду;
- різке зниження перфузії внутрішніх органів;
- прогресивний розвиток артеріальної гіпотензії (АТ ˂80–90/50 мм рт. ст.).
Поряд із цим виникає тканинна гіпоксія, метаболічний ацидоз, збільшується синтез ендотеліну-1, тромбоксану А2 і зменшується утворення оксиду азоту та простацикліну, в результаті чого спазмуються судини, підвищується агрегація тромбоцитів, активується згортальна система крові, знижується перфузія нирок, порушується функція печінки.
Клінічна картина характеризується задишкою, різким падінням САТ (≤80 мм рт. ст.), зниженням пульсового АТ, олігоурією чи анурією, блідістю шкіри, акроціанозом, сопорозним станом, ознаками набряку легень.
Незважаючи на значні успіхи в лікуванні пацієнтів із гострим ІМ, що дозволило значно знизити летальність при цьому захворюванні, кардіогенний шок, як і раніше, залишається основною причиною смерті хворих на ІМ навіть у так звану тромболітичну еру. При аутопсії у хворих, які померли від кардіогенного шоку, розміри ІМ становлять від 40 до 70% міокарда ЛШ (алгоритм 2.12).
| Алгоритм 2.12. Клінічна та інструментальна діагностика кардіогенного шоку Критерії діагностики кардіогенного шоку: І. Клінічні: 1. Периферичні ознаки: холодні вологі кінцівки; акроціаноз; спалі вени; малий частий пульс; час зникнення білої плями після натискання на нігтьове ложе триває >2 с. 2. З боку нирок: олігурія (˂20 мл/год). 3. Можливості порушення серцевого ритму: тахі- або брадикардія; різні блокади серця; миготлива аритмія; ШТ; ФШ, електромеханічна дисоціація, асистолія. 4. З боку ЦНС і периферичної НС: психомоторне збудження чи адинамія; сплутаність свідомості; розлади чутливості шкіри; зміни сухожильних рефлексів ІІ. Гемодинамічні: САТ ˂90 мм рт. ст., пульсовий АТ ˂20 мм рт. ст.; Тиск «заклинювання» в легеневій артерії >18 мм рт. ст.; Серцевий індекс ˂2,2 л/хв/м2; ЧСС ˂60 уд./хв або >120 уд./хв. Діагностичні критерії клінічних форм кардіогенного шоку: 1. Рефлекторний — больовий синдром із незначним зниженням судинного тонусу і АТ. 2. Аритмічний — зменшення ХОК в результаті тахі- чи брадикардії. 3. Справжній кардіогенний шок — зумовлений значним зниженням АТ та інотропної функції серця. 4. Ареактивний — найтяжча форма з розвитком вираженої гіпотензії, що не піддається консервативній терапії. Інструментальні критерії діагностики кардіогенного шоку: 1. ЕКГ-критерії: значна елевація сегмента ST у найгострішу стадію ІМ або глибокий зубець Q у багатьох відведеннях; тяжкі порушення ритму серця. 2. Критерії рентгенографії органів грудної клітки: вираженість застою крові в легенях; тиск «заклинювання» в легеневій артерії підвищується до 25 мм вод. ст.; ознаки застою крові в легенях можуть бути відсутні. 3. Критерії ехоКГ: ФВ ЛШ становить <45%; збільшені КСО і КДО (раннє ремоделювання ЛШ); підвищений систолічний тиск у легеневій артерії (>20 мм вод. ст.); може накопичуватися рідина у перикарді; відрив папілярних м’язів, розрив міжшлуночкової перегородки тощо. 4. Критерії коронарографії: субоклюзія — звуження КА до 97%, або оклюзія (≥98%). |
Фактори, що зумовлюють тяжкість кардіогенного шоку: зменшення маси скоротливого міокарда на ≥40–50%, розрив міжшлуночкової перегородки та папілярних м’язів, післяінфарктний дифузний кардіосклероз, тяжкі супутні захворювання (ЦД, гіпертонічна хвороба, вади серця, ХОЗЛ), розвиток тяжких аритмій та блокад серця (ФП, ШТ, повна АV-блокада тощо), кардіомегалія (значне збільшення порожнин серця), порушення мікроциркуляції, розвиток сладж-синдрому І–ІІІ ступенів, активація ПОЛ, зниження АОСЗ, розвиток субкомпенсованого та декомпенсованого метаболічного ацидозу, підвищення синтезу ендотеліну-1, тромбоксану А2, зниження оксиду азоту, простацикліну. ІМ призводить до розвитку кардіогенного шоку і відповідних гемодинамічних, гуморальних і біохімічним змін. При тяжкій формі справжнього кардіогенного шоку хворі зазвичай помирають протягом 3–4 год.
Невідкладна допомога при кардіогенному шоку наведена в алгоритмі 2.13.
| Алгоритм 2.13. Послідовність надання невідкладної допомоги при справжньому кардіогенному шоку Купірування больового синдрому та оксигенотерапія: 1. Морфін — 0,3–0,5 мл 1% розчину (3–5 мг) в/в. 2. Фентаніл — 2–3 мл 0,005% розчину і дроперидол — 2–3 мл 0,25% розчину) в/в, в/м. 3. Тримеперидин — 1 мл 1% розчину в/в. 4. Інгаляція зволожених парів кисню. Корекція тиску наповнення ЛШ здійснюється при величині діастолічного тиску в легеневій артерії менше 15–20 мм рт. ст., центрального венозного тиску менше 150 мм вод. ст. і відсутності вологих хрипів над легенями шляхом введення декстрану або декстрану + розчин натрію хлориду із розрахунку 20 мл/кг маси тіла. Підвищення інотропної та насосної функції міокарда: 1. Введення основних інотропних препаратів (симпатоміметиків) в/в: допамін (2 мл 4% розчину або 5 мл 0,5% розчину): <3 мкг/кг/хв — нирковий ефект; 3–5 мкг/кг/хв — інотропний ефект; >5 мкг/кг/хв — вазотропний ефект; норепінефрин 0,2–1,0 мкг/кг/хв; адреналін — 1 мг в/в при реанімаційних заходах кожні 3–5 хв, 0,05–0,5 мкг/кг/хв. 2. Диференційоване введення інотропних засобів залежно від величини САТ при кардіогенному шоку: САТ <60 мм рт. ст.: Допамін 200 мг, 5–15 мкг/кг/хв чи норепінефрин 8–16 мкг/хв. САТ 60–90 мм рт. ст.: Допамін 200 мг, 5–15 мкг/кг/хв. САТ >90 мм рт. ст.: Добутамін 250 мг, 2,5–15 мкг/кг/хв. При АТ >85 мм рт. ст. можна вводити препарат нового класу — кальцієвий сенсибілізатор/активатор левосимендан: початкова доза — 12 мкг/кг за 10 хв, потім — 0,05–0,2 мкг/кг/хв. Відновлення коронарного кровотоку за допомогою тромболітиків (введення одного із них до 6–12 год від початку захворювання) та запобігання ретромбозу: 1. Стрептокіназа — 1–1,5 млн ОД в/в крапельно впродовж 1 год. 2. Алтеплаза (тканинний активатор плазміногену) — 100 мг в/в упродовж 1,5 год за схемою. 3. Гепарин — 60 ОД/кг маси тіла в/в, п/ш, а потім — за схемою. 4. Еноксапарин натрій — 1 мг/кг кожні 12 год. 5. Фондапаринукс — 2,5 мг 1 раз на добу в/в. Агресивні методи лікування: Пацієнтів з ІМ, який ускладнився кардіогенним шоком, віком до 75 років за наявності протипоказань до тромболітичної терапії з високим ризиком смерті необхідно негайно госпіталізувати чи перевести в стаціонар, де є можливість виконання катетеризації серця з подальшою реваскуляризацією міокарда. З метою «відкриття» артерії в перші 12 год від початку ІМ з підйомом сегмента ST, включаючи справжній задній ІМ з гострою виниклою БЛНПГ і не пізніше 90–120 хв від моменту госпіталізації, проводять коронарографію, а потім такі агресивні методи терапії: 1. ТБКА і стентування КА. 2. Внутрішньоаортальна балонна контрапульсація. 3. АКШ. Термінове АКШ дозволяє знизити смертність при кардіогенному шоку до 5%. |
Для стентування КА використовують металеві стенти, стенти, покриті ліками більш ефективні, а останнім часом — саморозсмоктувальні стенти (рис. 2.9).
Інотропні засоби та вазодилататори по-різному впливають на показники центральної гемодинаміки (табл. 2.42).
| Препарат | Зниження | Посилення інотропної функції серця | Вазоконстрикція | |
| переднавантаження | післянавантаження | |||
| Допамін (у середніх дозах) | – | – | ++ | – |
| Допамін (у високих дозах) | – | – | ++ | ++ |
| Добутамін | + | – | +++ | – |
| Мілринон | ++ | ++ | +++ | – |
| Нітрогліцерин | +++ | + | – | – |
| Нітропрусид натрію | +++ | +++ | – | – |
Сучасні методи лікування блокад серця у хворих на ІМ викладені в рекомендаціях АНА/АСС (2004) щодо лікування блокад серця у хворих на ІМ (табл. 2.43, 2.44).
| Рекомендації | Клас рекомендацій | Рівень доказовості |
| іАПФ/БРА застосовують як тільки буде досягнута гемодинамічна стабільність у пацієнтів із ФВ <40% чи СН, щоб знизити ризик госпіталізації чи смерті | І | А |
| Терапія ББА рекомендована хворим із ФВ ЛШ ≤40% та/чи СН після стабілізації стану пацієнта для зниження ризику смерті, рецидиву ІМ і госпіталізації у зв’язку із СН | І | А |
| АМР пацієнтам із СН і ФВ ЛШ ≤40% без тяжкої ХНН/гіперкаліємії для зниження серцево-судинної госпіталізації та смерті | І | В |
| Петльові діуретики рекомендуються хворим із ГСН і симптомами перевантаження рідиною для усунення клінічної симптоматики | І | С |
| Нітрати рекомендовані пацієнтам із симптоматичною СН при САТ >90 мм рт. ст. для покращення клінічної симптоматики і зменшення застою. Кисень показаний хворим із набряком легень при SaO2 <90% для підтримки сатурації >95% | І | С |
| Інтубація показана пацієнтам із дихальною недостатністю, яка приводить до гіпоксемії, гіперкапнії чи ацидозу, якщо неінвазивна вентиляція не переноситься пацієнтом | І | С |
| Неінвазивну вентиляцію з позитивним тиском слід розглядати у пацієнтів із респіраторним дистресом (частота дихання >25 вдихів/хв, SaO2 <90%) без гіпотензії | ІІа | В |
| Призначення в/в нітратів або нітропрусиду натрію слід розглядати у пацієнтів із СН і підвищеним САТ для контролю АТ і покращення симптоматики | ІІа | C |
| Можна призначати опіати, які зменшують задишку і тривогу у пацієнтів із набряком легень і тяжкою задишкою. Частоту дихання потрібно контролювати | ІІb | B |
| Призначення інотропних засобів може розглядатися у пацієнтів із тяжкою СН і гіпотензією | ІІb | C |
| Контроль ЧСС у гострих ситуаціях | Клас рекомендацій | Рівень доказовості |
| Показано в/в ББА, якщо немає клінічних ознак ГСН | І | С |
| В/в аміодарон показаний для контролю частоти ритму за наявності ГСН та артеріальної гіпотензії | І | С |
| В/в дигоксин показаний для контролю частоти ритму за наявності ГСН та АГ | ІІа | В |
| Термінова електрична кардіоверсія показана, коли швидке досягнення контролю ЧСС за допомогою фармакотерапії у пацієнтів із ФП та ішемією, тяжким гемодинамічним порушенням або СН неможливе | І | С |
| В/в введення аміодарону показане для покращення проведення електричної кардіоверсії чи зниження ризику раннього рецидиву ФП після електричної кардіоверсії у хворих із недавнім початком | І | С |
| Хворим із ІМпST, ускладненим ФП, необхідно призначити тривалу антикоагулянтну терапію | ІІа | С |
| Дигоксин неефективний для перетворення недавно виниклої ФП у синусовий ритм і не застосовується для контролю ритму | ІІІ | А |
| БКК та ББА, виключаючи соталол, неефективні для перетворення ФП, що недавно виникла, у синусовий ритм | ІІІ | C |
| Профілактичне застосування ААП для запобігання ФП не показане | ІІІ | B |
Таким чином, при кардіогенному шоку враховують фактори, які зумовлюють тяжкість захворювання та його лікування, з обов’язковим застосуванням симпатоміметиків (добутаміну, допаміну), тромболітиків, декстрану + розчин натрію хлориду і ТБКА, а також стентування КА, що значно підвищує ефективність лікувальних заходів і знижує летальність. При блокадах серця необхідно застосовувати наведені рекомендації.
Помилки та необґрунтовані призначення у разі недотримання рекомендацій доказової медицини
При ІМ не рекомендується:
- профілактичне застосування ААП лідокаїну;
- застосування солей магнію за відсутності гіпомагніємії та тяжких шлуночкових аритмій;
- при ГКС без зміщення сегмента ST призначення морфіну в поєднанні з нітрогліцерином (порівняно з монотерапією нітрогліцерином) достовірно підвищує ризик несприятливого кінця і смертності (PKД СRUSADE);
- призначення похідних дигідропіридину короткої дії;
- тривале застосування нітратів за відсутності стенокардії.
Основні помилки фармакотерапії:
- відмова від проведення тромболітичної терапії у хворих на ІМ з елевацією сегмента ST, що поступили через 6–12 год після появи симптомів;
- проведення тромболітичної терапії за відсутності підйому сегмента ST чи БЛНПГ, що гостро виникла;
- введення лікувальних доз гепарину без контролю АЧТЧ (особливо небезпечне в поєднанні з тромболітичною терапією);
- відмова від застосування лікарських засобів, які покращують прогноз ІМ;
- недооцінка чи переоцінка протипоказань до застосування лікарських засобів;
- у разі застосування нітрогліцерину, добутаміну, допаміну, норепінефрину при тяжкій СН позитивні гемодинамічні зміни настають раніше, ніж клінічне покращення;
- оцінка результатів лікування на основі опосередкованих ознак (застій крові в легенях за даними об’єктивного обстеження, ступінь розтягнення вен шиї, дані рентгенологічного дослідження) можуть стати причиною невиправдано високих доз лікарських засобів.
Вторинна профілактика — це індивідуально підібрана медикаментозна терапія, спрямована на запобігання виникненню повторних епізодів гострої коронарної недостатності, застійної СН та летального кінця. Згідно з рекомендаціями доказової медицини, ефективними методами вторинної профілактики ІХС є застосування ББА, АСК, іАПФ, комбінації ББА та іАПФ. З іАПФ і ББА пов’язують підвищення якості життя та зниження ризику РСС та інших ускладнень ІХС, коли йдеться про АГ або СН будь-якого походження. У дослідженні САМЕLOT застосування амлодипіну порівняно з плацебо у пацієнтів із ІХС з нормальним рівнем АТ приводить до зниження ускладнень ССЗ і смертності від них. Засоби профілактики ІМ згідно з рекомендаціями доказової медицини запропоновано в табл. 2.45.
| Препарат | Клас | Рівень доказовості | |||
| І | ІІа | ІІb | ІІІ | ||
| АСК | Х | А | |||
| ББА в/в чи перорально | Х | А | |||
| іАПФ пероральні форми з першого дня: для всіх пацієнтів; для пацієнтів із високим ризиком | Х | Х | А А | ||
| Нітрати | Х | А | |||
| АК (верапаміл, дилтіазем) | Х | В | |||
| Магнію сульфат | Х | А | |||
| Лідокаїн усім пацієнтам | Х | В |
Профілактика кардіогенного шоку — це раннє, адекватне та сучасне лікування ІМ, спрямоване на запобігання розвитку ускладнень шляхом корекції факторів ризику.
Резюме. За даними досліджень можна зробити таке узагальнення:
- При ІМпST проведення тромболізису алтеплазою порівняно зі стрептокіназою ефективніше.
- Отримані переконливі докази здатності НМГ (еноксапарину) порівняно з НФГ підвищувати клінічну ефективність тромболітичної терапії за рахунок більш вираженого зниження тромбіну і меншої частки «рикошету» гіперкоагуляції після відміни еноксапарину, що підвищує ефективність антикоагулянтної терапії.
- У Рекомендаціях АСС/AHA і ЄТК з’явилися три нові положення:
1) доцільність антикоагулянтної терапії при тромболізисі стрептокіназою;
2) пролонгування антикоагулянтної терапії до 8 діб;
3) перевага надається застосуванню еноксапарину і фондапаринуксу (а не НФГ), оскільки введення останнього може спричиняти тромбоцитопенію. Ці терапевтичні варіанти лікування хворих на ІМ удосконалені протягом останніх 25 років.
- Оскільки прогнозується підвищення частоти і розподілу смертності від ІМ впродовж наступних 20 років, потрібно удосконалювати організаційні заходи і тактику лікування для запобігання розвитку епідемії цього захворювання у розвинутих країнах.
- Фондапаринукс та інші антикоагулянти, які інгібують фактор Ха, знижують смертність при ІМ через 30 днів від початку його розвитку. Отже, антикоагулянти еноксапарин і фондапаринукс ефективніші у профілактиці розвитку тромбоемболій, ніж НФГ (!).
- Рекомендується контролювати гіперглікемію при ІМ у поєднанні з ЦД і здійснювати її корекцію. Застосування глюкозоінсулінкалієвої суміші при ІМ без ЦД недоцільне, оскільки не впливає на прогноз захворювання і розвиток ускладнень.
- У разі неможливості застосування еноксапарину при ІМ і ХНН з економічних причин препаратом вибору є НФГ.
- Тривале, практично протягом усього життя, застосування АСК залишається основою вторинного профілактичного повторного некробіозу після перенесеного ІMпST.
- Аналіз результатів лікування за 10 років свідчить про наявне зниження смертності хворих на ІМ переважно за рахунок посиленої медикаментозної терапії після виписки зі стаціонару шляхом застосування ББА, іАПФ, БРА та антитромбоцитарних препаратів.
- Ішемічна хвороба серця
- Стабільна ішемічна хвороба серця
- Гострий коронарний синдром
- Гострий коронарний синдром без елевації сегмента ST, нестабільна стенокардія, інфаркт міокарда без зубця Q
- Інфаркт міокарда




