Стабільна ішемічна хвороба серця
Стенокардія — дуже поширене захворюванням в США. Захворювання описане більше 200 років тому англійським лікарем Геберденом.
Визначення
Стабільна стенокардія напруження — це напади болю за грудниною стабільного перебігу, що виникають на тлі стенозуючого атеросклерозу КА під впливом фізичного чи психоемоційного фактора, які призводять до підвищення потреби міокарда в кисні. При стабільній стенокардії її тяжкість протягом декількох тижнів залишається приблизно однаковою.
Патогенез. В основі больового синдрому при стенокардії лежить виникнення перехідної короткочасної ішемії міокарда, викликаної зменшенням коронарного кровообігу або збільшенням потреби міокарда в кисні. У вогнищі ішемії відбувається вивільнення хімічних субстанцій, яким притаманні властивості медіаторів болю. Головними з-поміж них є серотонін, гістамін, брадикінін; їх джерелом слугують тромбоцити, базофільні лейкоцити та тканинні гладкі клітини.
Основні фактори ризику ІХС: 1) тютюнопаління; 2) сімейний анамнез захворювання; 3) порушення ліпідного спектра крові; 4) ЦД; 5) підвищення АТ.
Діагностика ІХС та стенокардії наведена в алгоритмі 2.4.
| Алгоритм 2.4. Діагностика стабільної стенокардії напруження 1. Клінічно визначається нападоподібний біль за грудниною стискаючого чи пекучого характеру тривалістю 1–5–15 хв, що виникає після фізичного або психоемоційного навантаження, віддає в ліву руку або лопатку і купірується нітрогліцерином через 1–10 хв після його сублінгвального прийому. 2. На ЕКГ у спокої під час нападу стенокардії часто спостерігається патологічне зміщення сегмента ST над або під ізолінією з можливим ущільненням, сплощенням, двохфазним або негативним зубцем Т. 3. Позитивна велоергометрична проба, що підтверджує ІХС, характеризується виникненням на висоті навантаження нападу стенокардії чи зміщенням сегмента ST горизонтально над або під ізолінією на ≥1 мм (при косому зміщенні сегмента ST на ≥2 мм) при тривалості ST ≥0,08 с |
Для характеристики ступеня порушення коронарного кровообігу при стабільній стенокардії напруження використовують класифікацію Канадської асоціації кардіологів (табл. 2.14). Імовірність ІХС за клінічними ознаками в балах наведено в табл. 2.15.
| ФК | Умови виникнення стенокардії напруження |
| І | Напади стенокардії виникають рідко, тільки при дуже значних фізичних і психоемоційних навантаженнях, а також при швидкій ходьбі та підйомі сходами. Звичайна фізична активність не обмежена |
| ІІ | Напади стенокардії виникають при ходьбі по рівній місцевості на відстань понад 500 м, підйомі сходами більше ніж на один поверх. Імовірність нападу підвищується в холодну та вітряну погоду, при емоційному збудженні, після їжі та в перші години після пробудження. Звичайна фізична активність обмежена незначно |
| ІІІ | Біль виникає при повільній ходьбі по рівній місцевості в межах 100–500 м та 1–2 кварталів, підйомі на один поверх. Звичайна фізична активність значно обмежена |
| IV | Напади виникають при незначному фізичному навантаженні. Хворий не здатний обслуговувати себе у спокої. Напади виникають зазвичай в нічний час у лежачому положенні хворого, у спокої |
| № з/п | Показник | Значення | Бали |
| 1 | Стать/вік (років) | Ч/>55 Ж/>65 | 1 |
| 2 | Встановлений діагноз судинної патології | Так | 1 |
| 3 | Пацієнт визначає біль, як «біль у серці» | Так | 1 |
| 4 | Біль посилюється при фізичному навантаженні | Так | 1 |
| 5 | Біль не провокується пальпацією грудної клітки | Так | 1 |
Сума балів ≤2 дозволяє виключити діагноз ІХС з вірогідністю 81%, від 3 до 5 — підтвердити діагноз із вірогідністю 87%.
Програма діагностики (ВАКУ, 2018)
1. Визначення скарг/збір анамнезу.
2. У пацієнтів, які потребують встановлення діагнозу, — оцінка претестової імовірності ІХС (див. табл. 2.15).
3. Клінічний огляд.
4. Вимірювання АТ.
5. Лабораторне обстеження:
- первинне: загальний аналіз крові (обов’язкове визначення гемоглобіну та загальної кількості лейкоцитів), загальний аналіз сечі, біохімічні показники (глюкоза у сироватці крові, загальний ХС, ТГ, ХС ЛПНЩ, ХС ЛПВЩ, калій, натрій, креатинін, ШКФ);
- за підозри на клінічну нестабільність чи ГКС: визначення тропоніну;
- щорічний диспансерний огляд: гемоглобін, ліпіди, показники вуглеводного обміну, креатинін.
Додатково за показаннями:
- контроль печінкових ферментів — для пацієнтів, які застосовують статини;
- контроль креатинкінази/КФК — для пацієнтів із ризиком або симптомами можливої міопатії на фоні прийому статинів;
- глікозильований гемоглобін при підозрі на ЦД;
- за необхідності (наявність миготливої аритмії, клінічні симптоми) — тиреотропний гормон (ТТГ) для визначення функції щитоподібної залози;
- натрійуретичний пептид В типу при підозрі на СН.
6. ЕКГ у 12 відведеннях.
7. ЕхоКГ.
8. Тест із дозованим фізичним навантаженням (ДФН): велоергометрія або тредміл.
9. Неінвазивні тести з візуалізацією міокарда (за умови неінформативності проб з ДФН):
- стрес-ехоКГ з ДФН чи добутаміном;
- сцинтиграфія міокарда (однофотонна емісійна комп’ютерна томографія (ОФЕКТ)/позитронна емісійна томографія (ПЕТ)). Як радіонуклідний маркер найчастіше використовують 99mтехнецій, надається перевага тестам із фізичним навантаженням. Якість зображення дещо вища при використанні ПЕТ;
- стрес-тести з використанням МРТ. Метод використовують у поєднанні з фармакологічними агентами.
10. Неінвазивні методи дослідження анатомії КА: КТ (у пацієнтів із симптомами захворювання використання індексу кальцифікації не має значення для діагностики коронарного стенозу); МРТ-коронарографія (метод здебільшого використовується з дослідницькою метою).
- інвазивна коронарна ангіографія рекомендована пацієнтам із симптомами ІХС, в яких очікується безсумнівна користь від проведення реваскуляризації міокарда (стентування, АКШ) або визначається високий ризик кардіоваскулярних ускладнень (див. Стратифікація кардіоваскулярного ризику);
- для підтвердження/встановлення діагнозу інвазивна коронарна ангіографія показана пацієнтам, які неспроможні пройти стрес-тест з ДФН/візуалізацією міокарда, мають знижену ФВ ЛШ <40% і типову стенокардію чи є представниками певних професій (водії громадського транспорту, військові, авіапілоти тощо).
Додаткові дослідження
Рентгенівське дослідження грудної клітки — за наявності атипової симптоматики, при підозрі на СН чи захворювання дихальної системи.
Амбулаторне моніторування ЕКГ — при підозрі на вазоспастичну стенокардію чи за наявності симптомів, зумовлених порушеннями серцевого ритму, а також за необхідності — для оцінки ефективності терапії.
Класифікацію різних форм стабільної ІХС та больового синдрому в грудній клітці та класифікацію больового синдрому в грудній клітці наведено нижче.
Патогенетичні фактори різних форм стабільної стенокардії
та безбольової ішемії міокарда
Стенокардія навантаження виникає внаслідок:
- стенозу епікардіальної КА;
- мікроваскулярної дисфункції.
Стенокардія спокою виникає внаслідок вазоспазму:
- епікардіального локального;
- епікардіального дифузного;
- мікроваскулярного;
- поєднання вищеописаних механізмів.
Безсимптомна (безбольова) ІХС виникає:
- внаслідок недостатньої вираженості ішемії та/чи дисфункції ЛШ;
- незважаючи на ішемію та/чи дисфункцію ЛШ.
Клінічна класифікація больового синдрому в грудній клітці
Типова стенокардія (визначена) — за наявності усіх трьох характеристик:
1) загруднинний біль/дискомфорт відповідної якості й тривалості;
2) загруднинний біль провокується фізичним навантаженням чи емоційним стресом;
3) загруднинний біль зникає після відпочинку та/чи застосування нітрогліцерину упродовж декількох хвилин.
Атипова (ймовірна) стенокардія — за наявності двох із вищенаведених характеристик.
Біль іншого генезу — за наявності лише однієї чи відсутності вищенаведених характеристик.
Особливості 10 клінічних форм стабільної стенокардії:
1. Рання ранкова стенокардія виникає в період з 6 до 11-ї години ранку за рахунок активації симпатичної нервової системи (НС) (підвищення синтезу катехоламінів, кортизолу, підвищення ЧСС і АТ).
2. Стартова стенокардія зумовлена підвищенням вимог до серця у зв’язку з фізичним навантаженням без попереднього включення колатералей.
3. Стенокардія після прийому їжі виникає в результаті перерозподілу крові до органів травлення і розвитку синдрому «обкрадання» серця (зменшується приплив крові до серця і розвивається ішемія міокарда). Вона може виникати після вживання білкової їжі, особливо міцних бульйонів, які спричиняють підвищення ЧСС і основного обміну.
4. Стенокардія лежачого положення (dесubіtus) супроводжується зростанням венозного припливу крові до серця, перевантаженням і збільшенням потреби міокарда в кисні.
5. «Холодова» стенокардія спричинена спазмом периферичних артерій, підвищенням інотропної функції серця (збільшення постнавантаження).
6. «Статична» стенокардія спричинена різким статичним навантаженням (наприклад нагинання тулуба при взуванні).
7. «Тютюнова» стенокардія виникає від підвищення активності симпатичної НС (підвищення ЧСС, АТ, агрегації тромбоцитів, вазоконстрикції).
8. Стенокардія, що виникла після стресових ситуацій (неспокійного сну) розвивається за рахунок активації симпатоадреналової системи (підвищення синтезу катехоламінів, кортизолу, ЧСС, АТ).
9. Стенокардія «другого дихання», коли деякі пацієнти переборюють больовий синдром і можуть продовжувати навантаження (явища ішемічного прекондиціонування).
10. Стенокардія за типом пароксизмальної задишки (особливо у осіб похилого віку та при ЦД) виникає при ходьбі або під час сну, коли з’являється задишка (ядуха), що є еквівалентом стенокардії. Вона спричинена пониженням чутливих рецепторів, що відповідають за відчуття ангінозного болю.
Важливе значення має стратифікація кардіоваскулярного ризику, яка визначається на основі:
1) клінічних даних:
- в анамнезі АГ, ЦД, метаболічний синдром, перенесений ІМ;
- вік, спадковість, тютюнопаління;
- ураження периферичних артерій, кардіомегалія, СН;
2) ЕКГ-змін: ознаки перенесеного ІМ, блокада лівої ніжки пучка Гіса (БЛНПГ), ГЛШ, атріовентрикулярна (АV)-блокада ІІ–ІІІ ступеня, фібриляція передсердь (ФП), шлуночкові екстрасистоли ІІІ–V градації за Лауном, «пірует»-тахікардія, ФШ, асистолія та значне зміщення сегмента ST від ізолінії після фізичного навантаження;
3) дисліпідемії: підвищення вмісту загального ХС, ХС ЛПНЩ;
4) ехоКГ-змін: зниження ФВ ЛШ <45% призводить до щорічної смертності >3%; значне збільшення кінцево-систолічного об’єму (КСО) та кінцево-діастолічного об’єму (КДО), виникнення концентричної та ексцентричної гіпертрофії міокарда;
5) коронарографії: 12-річна виживаність на фоні медикаментозного лікування при незмінених КА спостерігається у 91%; у хворих з ураженням однієї КА — у 74%; двох — у 59%; трьох — у 50% випадків (РКД СASS).
Вазоспастична (варіантна) стенокардія Принцметала діагностується в 0,5–1% випадків і частіше трапляється у жінок віком до 50 років; її особливістю є несприятливий перебіг: у 25% випадків вона призводить до розвитку ІМ або РСС. У 25% пацієнтів зі стенокардією Принцметала відзначають супутню мігрень, ще у 25% хворих — феномен Рейно. У 50% пацієнтів варіантна стенокардія поєднується зі стенокардією напруження. У патогенезі вазоспастичної стенокардії має значення місцеве ураження стінки артерії, що сприяє адгезії тромбоцитів, які виділяють речовини (тромбоксан А2 і серотонін), що звужують судини, з виникненням локальної гіперактивності гладком’язових клітин КА до катехоламінів.
При цьому вночі або на світанку в певний час (з 12-ї години ночі до 8-ї години ранку) виникають напади стенокардії, яким властива циклічність, і з кожним наступним нападом їхня інтенсивність зростає. Стенокардія напруження у цих осіб не виникає, і пацієнти добре переносять фізичні навантаження. На ЕКГ у 70–80% випадків виникає підйом сегмента ST над ізолінією в ділянці передньої та задньої стінок ЛШ під час больового нападу, що свідчить про розвиток гострої трансмуральної ішемії міокарда. Однак у 20–30% хворих виникає депресія сегмента ST та інверсія зубця Т, що пояснюють розвиток неповної оклюзії судин. Водночас часто реєструють тяжкі порушення ритму серця (шлуночкова тахікардія (ШТ), ФШ, повна АV-блокада), що є факторами ризику РСС. За даними коронарографії майже у всіх хворих не виявляють змін у КА.
Кращими препаратами у таких випадках є антагоністи кальцію (АК), які усувають і запобігають виникненню спазму КА; ефективні також нітрати. Однак ББА цим пацієнтам протипоказані, оскільки вони збільшують вираженість нападів стенокардії. Хірургічні методи лікування дають негативні результати. Перспективнішим є пряме коронарне стентування без предилатації в зоні локального спазму. Незважаючи на відсутність атеросклеротичних змін у КА, цим хворим профілактично показані статини та АСК.
Ознаки, нехарактерні для ішемії міокарда:
- біль при сухому плевриті (гострий або ріжучий), який посилюється при глибокому вдиханні або покашлюванні;
- переважна чи єдина локалізація болю чи дискомфорту — середня чи нижня частина абдомінальної ділянки;
- біль розміром за площею кінчика пальця, особливо над верхівкою ЛШ або в кістково-хрящовому з’єднанні;
- біль повторно виникає під час руху або при пальпації грудної клітки чи рук;
- дуже короткочасні епізоди болю (тривалістю декілька секунд);
- біль, що іррадіює в нижні кінцівки.
Встановлено, що підйом сегмента ST та зміни зубця Т на ЕКГ спостерігаються при аневризмі ЛШ, перикардиті, міокардиті, синдромі ранньої реполяризації шлуночків (наприклад у чоловіків негроїдної раси), синдромі роздування верхівки ЛШ (кардіоміопатія такоцубо), синдромі Вольфа — Паркінсона — Уайта (WPW). Глибока інверсія зубця Т може спричинятися захворюваннями центральної нервової системи (ЦНС) і медикаментозною терапією (трициклічними антидепресантами або фенотіазинами). У диференційній діагностиці між стенокардією і кардіалгією велике значення має проведення велоергометричної проби.
Мета проведення тесту з ДФН:
- діагностика ІХС у пацієнтів із підозрою на стенокардію;
- оцінка функціональної тяжкості ІХС;
- оцінка ризику серцево-судинних подій;
- оцінка фізичної працездатності й толерантності до фізичного навантаження;
- оцінка симптомів, пов’язаних із виконанням навантажень;
- оцінка хронотропних можливостей, аритмій та реакції на лікування з використанням імплантованих пристроїв;
- оцінка ефективності медикаментозного лікування;
- визначення режиму індивідуальної фізичної активності після усунення симптоматики.
Переваги тесту з ДФН:
- відносна простота;
- широка доступність.
Показання до проведення навантажувальних проб:
- проведення диференційної діагностики ІХС;
- визначення індивідуальної толерантності до фізичного навантаження та уточнення ФК стенокардії;
- оцінка ефективності лікування та реабілітаційних заходів;
- експертиза працездатності пацієнтів із ССЗ;
- оцінка прогнозу;
- оцінка ефективності антиішемічних препаратів.
Абсолютні протипоказання до проведення навантажувальних проб:
- гостра стадія ІМ (2–7 днів);
- нестабільна стенокардія;
- порушення мозкового кровообігу;
- гострий тромбофлебіт;
- тромбоемболія легеневої артерії (ТЕЛА);
- СН ІІІ–ІV ФК згідно із класифікацією NYHA (New York Heart Association — Нью-Йоркська асоціація кардіологів);
- виражена легенева недостатність;
- лихоманка.
Основні клінічні ознаки позитивної велоергометричної проби: поява нападу стенокардії на висоті фізичного навантаження; ЕКГ-ознаки — горизонтальне зміщення сегмента ST на ≥1 мм, під ізолінією (косе зміщення сегмента ST на ≥2 мм) у трьох відведеннях при тривалості сегмента ST >0,08 с.
Додаткова інформація, що має діагностичне та прогностичне значення:
- реакції ЧСС та АТ;
- поява інших клінічних симптомів;
- потужність виконаної роботи під час навантаження.
Відсутність діагностичної цінності:
- БЛНПГ;
- штучний водій ритму;
- синдром WPW;
- зміни на ЕКГ спокою за рахунок ГЛШ, електролітного дисбалансу, порушень інтравентрикулярної провідності, ФП і застосування серцевих глікозидів;
- нижча чутливість і специфічність у жінок.
Проби можуть бути неінформативними:
- не вдається досягти 85% максимальної ЧСС за відсутності симптомів і ознак ішемії;
- неможливість проведення тесту з фізичним навантаженням у зв’язку з ортопедичними та іншими причинами;
- застосування антиішемічних препаратів.
Ознаки високого ризику ускладнень ІХС
за даними ЕКГ-проби з фізичним навантаженням
- Нездатність пройти 6 хв за протоколом Брюса.
- Рання поява ознак ішемії (≤3 хв).
- Різко позитивна велоергометрична проба (депресія сегмента ST ≥2 мм).
- Депресія сегмента ST, яка зберігається >3 хв після призупинення навантаження.
- Косонизхідна депресія сегмента ST.
- Ішемія при низькій ЧСС (≤120 уд./хв).
- Зниження чи відсутність приросту АТ під час навантаження.
- Загрозливі для життя шлуночкові аритмії при ЧСС ≤120 уд./хв.
Європейські та вітчизняні рекомендації передбачають можливість розрахунку кардіоваскулярного ризику за допомогою електронного калькулятора Duke за результатами проби з ДФН на тредмілі (www.cardiology.org/tools/medcalc/duke/).
Визначення кардіоваскулярного ризику залежно від результатів інших методів дослідження представлене в табл. 2.16.
| ЕКГ-проби з ДФН (індекс Duke) | Високий ризик | Смертність >3% |
| ЕКГ-проби з ДФН (індекс Duke) | Середній ризик | Смертність >1 і <3% |
| ЕКГ-проби з ДФН (індекс Duke) | Низький ризик | Смертність <1% |
| Метод візуалізації ішемії | Високий ризик | Ділянка ішемії >10% (ОФЕКТ >10%; МРТ >2/16 сегментів з новими дефектами перфузії; >3 добутамін-індукованих сегментів; >3 сегментів ЛШ на стрес-ехоКГ) |
| Метод візуалізації ішемії | Середній ризик | Ділянка ішемії 1–10% чи будь-яка ішемія меншого обсягу, ніж при високому ризику (МРТ, стрес-ехоКГ) |
| Метод візуалізації ішемії | Низький ризик | Ішемія відсутня |
| КТ-коронарографія | Високий ризик | Значні ураження категорії високого ризику (3-судинне ураження з проксимальними стенозами, стенозом стовбура лівої КА, проксимальним стенозом передньої низхідної міжшлуночкової артерії) |
| КТ-коронарографія | Середній ризик | Значні ураження в проксимальних сегментах головних артерій (за винятком тих, які належать до категорії високого ризику) |
| КТ-коронарографія | Низький ризик | Нормальні чи мало змінені КА |
Важливу інформацію можна отримати за допомогою ехоКГ. Порушення локальної скоротливості ЛШ свідчать про наявність ІХС. Помірна систолічна дисфункція ЛШ (ФВ <50%) та виражена мітральна недостатність свідчать про несприятливий прогноз. Слід відзначити, що від систолічної функції ЛШ і розвитку систолічної СН залежить медикаментозне лікування із застосуванням засобів, які покращують інотропну функцію серця.
Для детальнішої характеристики ЛШ, оцінки локальної скоротливості і визначення ФВ використовують МРТ. Це дослідження дозволяє також визначати зміни в КА.
У хворих зі стенокардією напруження часто наявна безбольова ішемія міокарда (ББІМ). Самостійно ББІМ виникає дуже рідко (близько 5% випадків), оскільки вона часто комбінується з больовою ішемією міокарда. Ознакою ББІМ є горизонтальна чи косонизхідна депресія сегмента ST тривалістю >1 хв при холтерівському моніторуванні ЕКГ. ББІМ виникає при меншому підвищенні ЧСС під час велоергометрії. Існує припущення, що ББІМ може бути навіть корисною, оскільки вона може стимулювати розвиток колатералей. Однак більшість вчених вважають, що епізоди ББІМ посилюють ураження міокарда, підвищують ступінь фіброзу та гіпертрофії міокарда у вогнищах повторної ішемії та можуть спричиняти різні аритмії. ББІМ діагностують переважно за допомогою холтерівського моніторування ЕКГ.
Існує правило розпізнавання ББІМ: 1 × 1 × 1 (величина сегмента ST зміщується не менше ніж на 1 мм, тривалість — не менше 1 хв, проміжок між двома епізодами зміщення сегмента ST — не менше 1 хв). Якщо ББІМ спостерігається у людей без нападів стенокардії, то їм для уточнення діагнозу показане проведення велоергометрії, стрес-ехоКГ чи сцинтиграфія міокарда з навантаженням. Як свідчать результати досліджень, при ББІМ найефективнішими є ББА (атенолол ефективніший за плацебо, а бісопролол ефективніший, ніж пролонговані форми ніфедипіну). Коронарографія є еталоном у діагностиці стенозування КА.
Показання до планового коронарографічного дослідження відповідно до ЄТК (2006) у пацієнтів зі стабільною стенокардією:
1) тяжка стенокардія (≥ІІІ ФК), особливо в разі неефективності медикаментозної терапії;
2) перенесена зупинка серця з успішною реанімацією;
3) тяжка шлуночкова аритмія;
4) поновлення помірної та вираженої стенокардії в ранні терміни після реваскуляризації КА;
5) неясний діагноз після проведення неінвазивних тестів або суперечливі результати цих тестів;
6) високий ризик рестенозу великої КА після ПКВ).
За ступенем стенозу визначають ризик розвитку ІМ. При стенозі КА >75% діаметра хоч однієї артерії смертність вища, ніж при стенозі <50% діаметра.
Навіть при легких стенозах ризик ІМ значно вищий, ніж за їх відсутності. Встановлено, що ⅔ ІМ спричиняються розвитком артеріальної бляшки, яка звужує артерію менше ніж на 50% діаметра. Бляшки з нерівними краями свідчать про високий ризик ІМ.
Інтракоронарне УЗД дозволяє отримати поперечні зрізи КА і розрахувати площу бляшки, калібр артерії та ступінь стенозу, дослідити ділянку затемнення неясного походження та сумнівні стенози, а також вміст у бляшці кальцію. Гіпоехогенні вогнища в бляшці вказують на високий вміст ліпідів, що свідчить про нестабільність бляшки.
Етапність надання медичної допомоги
Первинна медична допомога:
1. Виявлення та корекція факторів кардіоваскулярного ризику.
2. Діагностика ІХС: збір анамнезу, клінічний огляд, визначення претестової імовірності ІХС, реєстрація ЕКГ, лабораторне обстеження (загальний аналіз крові, сечі, ліпіди, глюкоза в крові, креатинін/ШКФ); за показаннями — додаткові лабораторні дослідження (див. вище); за наявності відповідного обладнання і спеціалістів — ехоКГ, УЗД сонних артерій.
3. Визначення супутньої патології, яка може зумовлювати відповідну симптоматику чи впливати на перебіг захворювання.
4. У хворих із вірогідним діагнозом стабільної стенокардії — оцінка її ФК (класифікація Канадської асоціації кардіологів).
5. Навчання пацієнта оптимальної медикаментозної терапії (ОМТ).
6. Фармакотерапія у пацієнтів зі стабільною ІХС — призначення ОМТ за відсутності протипоказань (нітрогліцерин для купірування нападів стенокардії + ББА (або блокатор кальцієвих каналів (БКК)) + АСК + статин + за показаннями — інгібітор ангіотензинперетворювального ферменту (іАПФ), інші засоби). Контрольний візит для оцінки ефективності терапії — протягом першого тижня після її призначення.
7. Скринінг пацієнтів, які потребують направлення до закладу/спеціаліста вторинного рівня для підтвердження діагнозу, вибору методів лікування (реваскуляризація міокарда тощо).
8. Виявлення ознак ГКС, ІМ та направлення цих хворих до відповідних медичних закладів для надання високоспеціалізованої допомоги (третинного рівня).
9. Диспансерний нагляд.
10. Скринінг ознак/симптомів депресії у пацієнтів зі встановленим діагнозом ІХС відповідно до УКПМД «Депресія» (наказ МОЗ України від 25.12.2014 р. № 1003).
Вторинна медична допомога:
1. Оцінка щодо попереднього виявлення та корекції факторів кардіоваскулярного ризику.
2. Діагностика ІХС: збір анамнезу, клінічний огляд, визначення претестової імовірності ІХС, оцінка даних ЕКГ (за показаннями — повторна реєстрація), оцінка результатів лабораторного обстеження; за показаннями — додаткові лабораторні та інструментальні дослідження.
3. ЕхоКГ, УЗД сонних артерій, якщо їх не було проведено раніше.
4. Для верифікації діагнозу та подальшої стратифікації ризику — проби з ДФН (тредміл-тест, велоергометрія).
5. Стратифікація ризику за клінічними показниками та результатами проб з ДФН (номограма M. Lauer, індекс Duke).
6. Фармакотерапія пацієнтів зі стабільною ІХС — оцінка ефективності попередньо призначеної терапії, її корекція. Контрольний візит для оцінки ефективності лікування — протягом першого тижня після її призначення.
7. Скринінг пацієнтів, які потребують направлення до закладу третинного рівня:
- для підтвердження діагнозу ІХС (за умови недостатньої інформативності чи протипоказань до проведення проб із ДФН);
- визначення пацієнтів із ІХС високого/середнього ризику, які потребують проведення інвазивної коронарної ангіографії з подальшим вирішенням питання про можливість реваскуляризації міокарда (див. також вищенаведену інформацію щодо стратифікації ризику);
- виявлення ознак нестабільного перебігу захворювання.
8. Навчання пацієнта.
9. Диспансерний нагляд.
10. Скринінг ознак/симптомів депресії у пацієнтів зі встановленим діагнозом ІХС відповідно до УКПМД «Депресія» (наказ МОЗ України від 25.12.2014 р. № 1003), якщо він не був проведений на попередньому етапі.
11. Направлення пацієнтів до інших спеціалістів для лікування супутньої патології — за показаннями.
Третинна (високоспеціалізована) медична допомога:
1. Оцінка щодо виявлення та корекції факторів кардіоваскулярного ризику на попередніх етапах. Додаткові заходи стосовно модифікації способу життя, контролю ліпідних показників, АТ, глікемії — за показаннями.
2. Діагностика ІХС: збір анамнезу, клінічний огляд, визначення претестової імовірності ІХС, оцінка даних ЕКГ (за показаннями — повторна реєстрація), оцінка результатів лабораторного обстеження; за показаннями — додаткові лабораторні дослідження.
3. ЕхоКГ, УЗД сонних артерій, якщо їх не було проведено раніше або вони вимагають уточнень.
4. Оцінка результатів попередніх проб із ДФН (тредміл-тест, велоергометрія). У разі, якщо зазначені проби неінформативні чи не могли бути проведені з відповідних причин, рекомендовані навантажувальні/фармакологічні тести з візуалізацією міокарда. Для визначення ступеня ураження коронарного русла проводяться інвазивна коронарна ангіографія, КТ-коронарографія.
5. Діагностика особливих форм стабільної ІХС (вазоспастичної, мікроваскулярної, рефрактерної стенокардії).
6. Стратифікація ризику за клінічними показниками та результатами діагностичних досліджень.
7. Вибір методу лікування для пацієнтів із ІХС високого ризику (за показаннями для хворих із середнім ризиком): після інвазивної коронарної ангіографії визначення можливості та способу реваскуляризації міокарда.
8. Фармакотерапія пацієнтів зі стабільною ІХС — оцінка ефективності попередньо призначеної терапії, за необхідності — її корекція. Контрольний візит для оцінки ефективності медикаментозного лікування — протягом першого тижня після його призначення.
9. Виявлення ознак ГКС та ІМ; забезпечення цим хворим відповідного лікування.
10. Навчання пацієнта.
11. Диспансерний нагляд.
12. Скринінг ознак/симптомів депресії у пацієнтів із встановленим діагнозом ІХС відповідно до УКПМД «Депресія» (наказ МОЗ України від 25.12.2014 р. № 1003), якщо його не було проведено на попередньому етапі.
13. Направлення пацієнтів до інших спеціалістів для лікування супутньої патології — за показаннями.
Лікування ішемічної хвороби серця
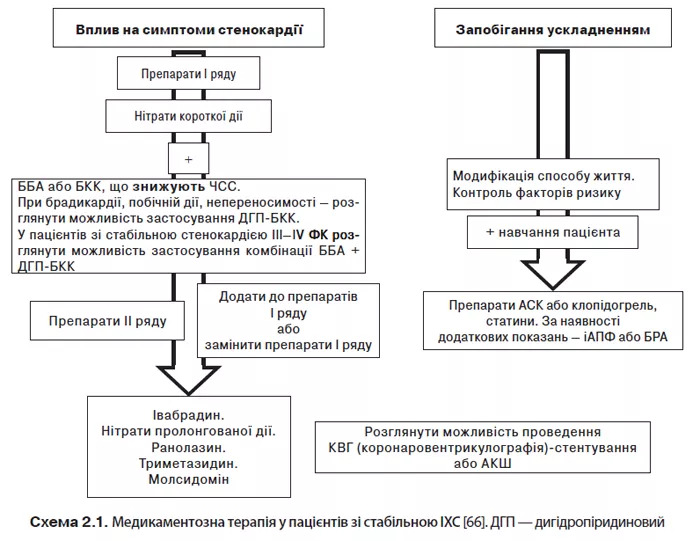
Лікувальні заходи повинні включати корекцію чинників ризику, відмову від тютюнопаління, дотримання гіполіпідемічної дієти, контролю АТ, ЧСС, зменшення маси тіла в пацієнтів з ожирінням, адекватне лікування при ЦД, контрольоване підвищення фізичного навантаження, усунення психологічних чинників (схема 2.1).
Хворий перш за все повинен відмовитися від тютюнопаління. Не так давно вважали, що тютюнопаління менше ніж 10 цигарок на день не впливає на кардіоваскулярний ризик, однак в РКД ІNTERHEART показано, що будь-яка кількість викурених цигарок завдає суттєвої шкоди, навіть одна цигарка на день. Паління 1–5 цигарок за добу підвищує ризик гострого ІМ на 40%, 20 — на 400%, 40 цигарок — на 900%. Тютюнопаління — найбільш потужний фактор ризику ІМ; викурювання навіть 1–5 цигарок на день може нівелювати 75% користі від лікування статинами. Тютюнопаління спричиняє дисфункцію ендотелію та знижує рівень ХС ЛПВЩ. Відмова від цієї шкідливої звички знижує ризик смерті від ССЗ в 1,5–2 рази.
Дуже важливим фактором є зменшення маси тіла у пацієнтів з ожирінням, оскільки надмірна маса тіла посилює практично всі фактори ризику ІХС. Позитивним є також вплив контрольованих тренувань. Спеціальними дослідженнями переконливо доведено, що фізичні навантаження у пацієнтів із ІХС знижують загальну смертність на 24%, смертність від ІХС — на 20–25%, сумарний коронарний ризик — майже на 30%. Фізичні навантаження середньої інтенсивності сповільнюють прогресування коронарного атеросклерозу. Помірна фізична активність підвищує рівень ХС ЛПВЩ, нормалізує функцію ендотелію, знижує АТ, ІМТ та рівень СРБ.
Пацієнтам із ІХС призначають такі дозволені фізичні тренування динамічного характеру: ходьба, легкий біг, плавання, велосипед. Переважній більшості хворих достатньо ходьби на відстань 2,5 км упродовж 30 хв. Тренування небажано проводити в ранковий час, оскільки вранці відзначається зниження порогу виникнення стенокардії та посилення вазоконстрикції. Спочатку тренувальні фізичні навантаження становлять 50–60% попередньої потужності, а потім їх збільшують до 70%. ЧСС за 1 хв повинна бути на 10–12 скорочень меншою від того рівня, коли виникає біль.
Велике значення в терапії та профілактиці ІХС має дієтичне лікування. У Ліонському РКД хворим із перенесеним ІМ було рекомендовано дотримуватися середземноморської дієти, що передбачає вживання великої кількості овочів і фруктів, нежирних молочних продуктів, чорного хліба, часнику, морської риби, сухого вина. У пацієнтів, які дотримувалися дієти, ризик ускладнень після гострого ІМ знизився на 47%, загальна смертність — майже на 50%.
У лікуванні при стабільній ІХС застосовують антиангінальні засоби І ряду (ББА, АК, нітрати), ІІ ряду (блокатори If-каналів, нікорандил, ранолазн, триметазидин) та інші препарати (статини, антитромбоцитарні препарати, іАПФ тощо), а також інтервенційні та хірургічні методи (табл. 2.17).
| Назва фармакологічної групи | Міжнародна непатентована назва препарату | Рекомендовані терапевтичні дози |
| Периферичні вазодилататори для лікування хвороб серця. Органічні нітрати | Нітрогліцерин Ізосорбіду динітрат Ізосорбіду мононітрат | 0,3–0,5 мг в 1 дозі 1,25 мг в 1 дозі (спрей); 5 мг в 1 дозі (таблетки сублінгвальні); 20–120 мг/добу в 1 дозі (спрей); 5 мг в 1 дозі (таблетки per os, пролонговані) 40–160 мг/добу |
| ББА: селективні; неселективні; комбіновані блокатори альфа- і бета-адренорецепторів | Атенолол Бетаксолол Бісопролол Метопролол Пропранолол Карведилол | 50–100 мг/добу (макс. добова доза — 200 мг) 10–20 мг/добу (макс. добова доза — 40 мг) 5–10 мг/добу (макс. добова доза — 20 мг) 50–100 мг 2 рази на добу (макс. добова доза — 400 мг) 40–320 мг/добу (макс. добова доза — 320 мг) 25–50 мг/добу |
| БКК: недигідропіридинові; похідні фінілалкіламіну; похідні бензодіазепіну; похідні дигідропіридину | Верапаміл Дилтіазем Амлодипін Ніфедипін Фелодипін | 80–480 мг/добу 120–480 мг/добу 5–10 мг/добу 40–120 мг/добу 5–10 мг/добу |
| іАПФ | Периндоприлу аргінін Периндоприлу тертбутиламін Раміприл | 5–10 мг/добу 4–8 мг/добу 2,5–10 мг/добу |
| Антитромбоцитарні препарати: антиагреганти — препарати АСК; антиагреганти — похідні тієнопіридину | АСК Клопідогрель | 75–100 мг/добу 75 мг/добу |
| Гіполіпідемічні засоби (статини) | Аторвастатин Пітавастатин Розувастатин Симвастатин | 10–80 мг/добу 2–4 мг/добу 10–40 мг/добу 20–40 мг/добу |
| Гіполіпідемічні засоби: похідні фібрової кислоти; інші гіполіпідемічні засоби | Фенофібрат Езетиміб | 200 мг/добу 10 мг/добу |
| Селективні блокатори If-каналів | Івабрадин | 10–15 мг/добу |
| Інші кардіологічні засоби | Ранолазин | 1000–2000 мг/добу |
| Антиішемічний засіб | Триметазидин | 70 мг/добу |
| Периферичні вазодилататори для лікування хвороб серця | Молсидомін | 2–8 мг/добу (макс. добова доза — 12 мг) |
Примітка. До переліку включені препарати, зареєстровані в Україні та внесені у Державний формуляр лікарських засобів (10-й випуск, 2018 р.).
ББА. Результати РКД з доказової медицини свідчать про те, що ББА запобігають розвитку повторних ІМ (у тому числі у хворих на стенокардію в поєднанні з ЦД). У цих пацієнтів адекватність дози ББА визначають за рівнем ЧСС у спокої (зменшувати до 50–55 уд./хв) та при фізичному навантаженні. Рекомендовані терапевтичні дози ББА становлять: метопрололу — 50–200 мг, бісопрололу — 5–10 (максимальна — 20) мг, карведилолу — 25–50 мг, пропранололу — 80–320 мг.
Нещодавно створено новий клас антиангінальних засобів — інгібітори Іf-каналів синусового вузла, які діють виключно шляхом зниження ЧСС. Препарат цієї групи івабрадин має виражену антиішемічну дію, тому його застосовують при стенокардії по 10–15 мг/добу замість або разом з ББА. У пацієнтів зі стенокардією івабрадин приводить до суттєвого збільшення часу перфузії в діастолу на 41%. Препарат покращує функцію колатералей. Покращення функції міокарда цими двома шляхами зумовлює виражений антиангінальний ефект та зменшення кількості нападів стенокардії на 51–70%.
АК верапаміл і дилтіазем у хворих на стенокардію, які перенесли ІМ, не знижують кардіальної смертності, а короткодіючі препарати ДГП ряду (ніфедипін та його аналоги) приводять до активації симпатичної НС, роботи серця, підвищення ЧСС і збудливості міокарда, що призводить до зростання кількості повторних ІМ і смертності від ІХС. Застосовують АК у таких дозах: верапаміл — 80–480 мг/добу, дилтіазем — 120–480 мг/добу, амлодипін — 5–10 мг/добу, ніфедипін — 40–120 мг/добу, фелодипін — 5–10 мг/добу.
Нітрати усувають стенокардію (симптоматичне лікування). Це найстаріші антиангінальні препарати, які займають важливе місце в лікуванні при стабільній ІХС. Ізосорбіду динітрат призначають у дозі 20–120 мг/добу; ізосорбіду мононітрат — 40–160 мг/добу.
Нітрати діляться на препарати короткої та тривалої дії. Вони виявляють антиішемічну дію, розширюють венозні судини (переднавантаження) та артеріальні судини (післянавантаження), включаючи КА. Препарати діють як ендотелійнезалежні донатори оксиду азоту, що вивільняються у процесі їхнього метаболізму. Нітрогліцерин застосовують сублінгвально (у одній дозі — 0,5 мг) кожні 5 хв до припинення нападу. Нітрогліцерин у формі спрею діє швидше.
Для профілактики виникнення нападів стенокардії використовують нітрати тривалої дії — динітрати та мононітрати.
Ізосорбіду динітрат (5 мг сублінгвально) дозволяє усунути напад стенокардії приблизно упродовж 1 год, його антиангінальний ефект розвивається повільніше, ніж після прийому нітрогліцерину.
Нітрати тривалої дії застосовують для профілактики нападів стенокардії. Однак вони можуть втрачати антиангінальну дію в результаті розвитку феномену толерантності. Для запобігання розвитку толерантності до нітратів рекомендується обов’язково робити перерву в їх застосуванні протягом 8–10 год/добу.
Ранолазин — селективний інгібітор пізнього натрієвого струму, має антиішемічні та метаболічні властивості. Препарат у дозі 1000–2000 мг/добу зменшує вираженість симптомів стенокардії та підвищує толерантність до фізичного навантаження без впливу на ЧСС і рівень АТ. У 2009 р. Європейська медична асоціація (European Medical Association — ЕМА) схвалила застосування ранолазину для додаткового лікування при стабільній ІХС. У проведених РКД MERLIN-TIMI 36 на 6560 хворих доведено, що ранолазин у пацієнтів із ГКС без елевації сегмента ST не викликав суттєвого ефекту. Проте у підгрупі осіб із хронічною стенокардією, яка передувала ГКС, ранолазин знижував частоту рецидивів ішемії міокарда.
Молсидомін — прямий донатор оксиду азоту, його антиішемічна дія подібна до ізосорбіду динітрату. Одноразовий прийом молсидоміну тривалої дії у дозі 4–8 мг.
Сучасні погляди на комбіновану антиангінальну терапію при резистентній стенокардії такі. За результатами РКД ТІВЕТ (1996), FERGUSON (2000), PENRSSON (2000) не доведено значних допоміжних переваг різних комбінацій антиішемічних препаратів перед монотерапією. У разі недостатньої ефективності монотерапії обґрунтованою є комбінація одного чи двох антиангінальних препаратів із триметазидином (РКД TRІMPOL-ІІ, 2000; TRІKET, 2000).
У лікуванні пацієнтів із стабільною стенокардією велике значення надають гіполіпідемічним препаратам (табл. 2.18). Першочергове завдання лікаря — стабілізувати атеросклеротичну бляшку і не дати їй змоги розірватися.
Відомі три основні причини, що призводять до розриву бляшки: 1) багате на ліпіди та ефіри ХС ядро; 2) тонка, нестабільна і запальна покришка бляшки; 3) дисфункція ендотелію в її ділянці. Єдиним універсальним класом лікарських засобів, які не тільки блокують синтез ХС, але і впливають на всі фактори ризику розриву бляшки, є статини, без яких неможливо ефективно лікувати ІХС. Результатами двох РКД 4S (із вторинної) та WOSKOPS (із первинної профілактики гострих судинних подій) доведено, що статини для лікування атеросклерозу так само необхідні, як антибіотики при тяжких інфекційних хворобах. Середня добова доза статинів становить: симвастатину — 20–40 мг, аторвастатину — 20–80 мг, розувастатину — 10–40 мг, пітавастатину — 2–4 мг/добу.
| Рекомендації | Клас рекомендацій | Рівень доказовості |
| ОМТ включає принаймні один препарат для зменшення вираженості симптомів стенокардії/ішемії + препарати для запобігання кардіоваскулярним ускладненням | І | С |
| Рекомендується надавати пацієнтам інформацію про захворювання, фактори ризику і стратегії лікування | І | С |
| Рекомендується провести оцінку стану пацієнта протягом 1 тиж після призначення терапії | І | С |
| Рекомендується призначення нітратів короткої дії для купірування нападів стенокардії та запобігання їх виникненню (нітрогліцерин, ізосорбіду динітрат у формі сублінгвальних таблеток, аерозолів) | І | В |
| Антиангінальна терапія першої лінії включає ББА для контролю ЧСС і симптомів захворювання. У разі недостатньої ефективності монотерапії стенокардії ІІІ–IV ФК рекомендоване призначення двох препаратів: ББА, ДГП БКК. За наявності брадикардії показані ДГП БКК | І | А |
| До препаратів другої лінії відносять нітрати тривалої дії, івабрадин, нікорандил, ранолазин; вибір конкретного засобу залежить від ЧСС, АТ, переносимості лікування тощо. Ці засоби за потреби можуть поєднуватися з препаратами першої лінії | ІІа | В |
| Триметазидин можна розглядати як препарат другої лінії | ІІb | В |
| В окремих групах пацієнтів можна розпочати лікування з препаратів другої лінії — залежно від супутніх захворювань, відповідних протипоказань та переносимості лікування | І | С |
| У безсимптомних пацієнтів із великою зоною ішемії (>10%) слід розглянути доцільність призначення ББА | ІІа | С |
| У пацієнтів із вазоспастичною стенокардією рекомендується застосовувати БКК та нітрати; ББА слід уникати | ІІа | В |
| АСК в низьких дозах (75–100 мг) рекомендовано щоденно всім пацієнтам зі стабільною ІХС за відсутності протипоказань | І | А |
| При непереносимості АСК альтернативою є призначення клопідогрелю | І | В |
| Статини рекомендовані всім пацієнтам зі стабільною ІХС за відсутності протипоказань. Цільовий рівень ХС ЛПНЩ <1,8 ммоль/л; загального ХС <4,0 ммоль/л або зниження зазначених показників >50% у разі неможливості досягнення цільових рівнів | І | А |
| іАПФ (або БРА) рекомендовані за наявності супутньої патології (СН, АГ або ЦД) | І | А |
Враховуючи роль запальних процесів у розвитку атеросклеротичної бляшки, широко застосовують антиагреганти, до яких належать АСК, клопідогрель.
Серед антиагрегантів найбільш вивчена клінічна ефективність АСК. У хворих, які перенесли ІМ, призначення АСК у дозі 75–100 мг/добу призводить до зниження ризику повторного розвитку ІМ, інсультів, РСС. Пацієнтам із протипоказаннями до АСК та клопідогрелю, який застосовують у дозі 75 мг/добу, рекомендується за показаннями призначати варфарин. Комбінована терапія АСК та клопідогрелем рекомендується пацієнтам із ІХС з високим ризиком ускладнень (багатосудинне ураження у пацієнтів із супутнім ЦД), а також при ГКС, для профілактики рестенозів після хірургічної реваскуляризації КА.
Встановлено, що клопідогрель безпечніший і краще переноситься, ніж тиклопідин, а нейтропенія у групі пацієнтів, які приймали клопідогрель, виникала не частіше, ніж у групі з АСК (РКД СAPRІE, СHARІSMA).
Комбіновану терапію АСК і клопідогрелем пацієнтам з ІМ необхідно застосовувати протягом 9–12 міс. Користь цього підходу переконливо доведена результатами РКД.
Особливості дії антитромбоцитарних препаратів:
1. Антитромботичний ефект АСК зумовлений пригніченням агрегації тромбоцитів за рахунок незворотної блокади в них ферменту циклооксигенази (ЦОГ)-1 і майже повного пригнічення продукції тромбоксану А2. Доведено, що ЦОГ-1 дуже чутлива до дії АСК, вона в десятки разів перевищує таку ЦОГ-2, що відповідає за продукцію простацикліну в ендотелії судин. Отже, в низьких дозах (75–100 мг/добу) АСК блокує тільки ЦОГ-1 та інтактна до ЦОГ-2; відбувається переважне зниження продукції тромбоксану А2, тоді як рівень простацикліну (сильного природного вазодилататора і антиагреганта) зберігається достатньо високим. Проте у вищих дозах АСК спричиняє пригнічення ЦОГ-1 і ЦОГ-2.
2. Клопідогрель — селективний неконкурентний антагоніст рецепторів тромбоцитів до аденозиндифосфату (АДФ) зі своїми рецепторами і подальшим запобіганням активації комплексу глікопротеїну ІІb/ІІІа. Ефективність клопідогрелю доведена в РКД САPRІE, в якому показано перевагу клопідогрелю (в дозі 75 мг/добу) над АСК (у дозі 325 мг/добу) у 7,3% випадків. Клопідогрель — ефективний препарат у лікуванні пацієнтів, нечутливих до АСК або із протипоказаннями до його застосування.
3. У групі пацієнтів, які отримували комбіновану терапію (клопідогрель + АСК), відносний ризик розвитку судинних подій (повторна госпіталізація, ішемічний інсульт, ІМ, РСС) знизився на 6,4% порівняно із групою пацієнтів, які отримували монотерапію клопідогрелем, однак вдвічі збільшилася кількість життєзагрозливих побічних реакцій. Поряд з цим у групі хворих із клінічними проявами атеросклерозу ця комбінована терапія приводила до зниження частоти повторного розвитку інсульту, ІМ і судинної смерті на 12,5% порівняно із терапією АСК.
4. Неефективність антиагрегантної фармакотерапії може бути спричинена порушенням чутливості рецепторів-мішеней — глікопротеїнових (ГП) рецепторів, а також судинної стінки, можливо, в результаті змін антитромбогенної та антиагрегантної активності її ендотеліальної вистилки.
5. Інколи визначається резистентність до АСК — це нездатність препарату запобігти виникненню тромботичних ускладнень, збільшувати час кровотечі та впливати на параметри функції тромбоцитів іn vіtro, а також інгібувати синтез тромбоксану А2 («біохімічна форма резистентності»), яка трапляється при ІХС у 9–43%, при інсульті — у 3–36% випадків. Причини розвитку резистентності до АСК: неадекватна доза, низька абсорбція препарату в ШКТ, одночасне застосування нестероїдних протизапальних препаратів (НПЗП), функціональний стан тромбоцитів, підсилена чутливість тромбоцитів до АДФ і колагену, тютюнопаління, гіперхолестеринемія, стрес, фізичне навантаження тощо. Резистентність до клопідогрелю відзначають рідше — у 5–15% випадків. Слід зазначити, що терапія стосовно резистентності до АСК досі не розроблена.
При стабільній стенокардії також призначають іАПФ пацієнтам із порушеннями систолічної функції ЛШ і особам із ІХС в поєднанні з АГ та ЦД. У РКД НОРЕ (2000), EUROPA (2003) доведено вазопротекторну дію раміприлу та периндоприлу у хворих зі збереженою систолічною функцією ЛШ та їхня ефективність у зменшенні вираженості та частоти серцево-судинних ускладнень (ІМ, інсульт, СН). ІАПФ можуть знижувати потребу міокарда в кисні, меншою мірою — після фізичного навантаження.
Комбіноване лікування. Нещодавно стала доступною перша фіксована комбінація ББА бісопрололу та іАПФ периндоприлу (престилол). Призначення фіксованої комбінації має перевагу для пацієнтів з ІХС, яким показані ці два класи, оскільки спрощений режим прийому в одній таблетці підвищує їх прихильність до лікування.
Терапію та заходи щодо вторинної профілактики необхідно розпочати під час стаціонарного етапу лікування хворого після процедури реваскуляризації міокарда (табл. 2.19).
| Рекомендації | Клас рекомендацій | Рівень доказовості |
| Загальні положення | ||
| Усім пацієнтам — заходи щодо вторинної профілактики (включаючи корекцію факторів ризику, призначення статинів, відповідної антитромбоцитарної терапії, за потреби — антиангінальних препаратів), диспансерний нагляд | І | А |
| Усім пацієнтам — відповідний інструктаж перед поверненням до трудової діяльності та звичної фізичної активності. Хворих необхідно поінформувати, що у разі появи/повернення симптоматики слід звертатися до лікаря | І | С |
| Антитромбоцитарна терапія | ||
| Антитромбоцитарна терапія із застосуванням одного засобу (зазвичай АСК) — для постійного прийому | І | А |
| Подвійна антитромбоцитарна терапія — щонайменше 1 міс після імплантації непокритого металевого стента | І | А |
| Подвійна антитромбоцитарна терапія — протягом 6–12 міс після імплантації елютинг-стента | І | В |
| Подвійна антитромбоцитарна терапія >1 року в пацієнтів із високим ризиком ішемічних ускладнень (включаючи тромбоз стента, повторний ГКС на подвійній антитромбоцитарній терапії, ІМ, дифузне ураження КА), за умови низького ризику кровотеч | ІІb | В |
| Подвійна антитромбоцитарна терапія — протягом 1–3 міс за наявності високого ризику кровотеч, у разі необхідності невідкладних оперативних втручань чи супутнього лікування із застосуванням препаратів антикоагулянтів | ІІb | С |
Хворим із нечастими нападами стенокардії, особливо в похилому віці, нерідко достатньо рекомендувати прийом нітрогліцерину, коли напад не минає протягом 2–3 хв після припинення навантаження; профілактично призначають ізосорбіду динітрат чи ізосорбіду мононітрат перед фізичним навантаженням. При частих нападах стенокардії напруження до лікування додають ББА (підбір доз проводять не лише за антиангінальним ефектом, але із урахуванням зниження ЧСС (близько 50–55 уд./хв). У разі протипоказань до ББА додають АК.
При стенокардії ІІІ–ІV ФК нерідко застосовують поєднання 2–3 препаратів (наприклад нітрат + бісопролол + амлодипін). Комбінацію ББА з АК верапамілом та дилтіаземом не використовують, оскільки це поєднання спричиняє виражену брадикардію, гіпотонію та АV-блокаду. Однак якщо у хворого спостерігається тахікардія на тлі нормального інтервалу P–Q без клінічних проявів СН, ефективним може бути застосування поєднання ББА з АК верапамілом чи дилтіаземом.
Нітрати призначають переважно перед фізичним навантаженням. Постійний прийом нітратів некорисний і навіть шкідливий, оскільки виникає толерантність — прогресивне зменшення чи повне зникнення антиангінальної дії препаратів. У разі недостатньої ефективності лікування застосовують антиішемічний препарат триметазидин по 70 мг/добу.
Лікарю-кардіологу часто доводиться мати справу з резистентними до лікування формами стенокардії (табл. 2.20).
| Клас препаратів | Побічні ефекти (дуже часті й часті) | Застереження | Негативна взаємодія препаратів | Застосовувати не можна |
| Нітрати короткої/тривалої дії | Головний біль. Гіперемія. Гіпотензія. Синкопальні стани і поступова гіпотензія. Рефлекторна тахікардія. Метгемоглобінемія | Обструктивна форма ГКМП | Інгібітори фосфодіестерази-5 (силденафіл і подібні препарати) ББА БКК | |
| ББА (атенолол, метопролол-СР, бісопролол, карведилол) | Втомлюваність. Депресія. Брадикардія та блокади. Бронхоспазм. Периферична вазоконстрикція. Поступальна гіпотензія. Імпотенція. Гіпоглікемія/маскування ознак гіпоглікемії | Низька ЧСС чи порушення провідності. Кардіогенний шок. Астма. ХОЗЛ: з обережністю можна призначати кардіоселективні ББА в разі коректного призначення інгаляційних стероїдів чи β-агоністів тривалої дії. Тяжкий перебіг захворювання периферичних артерій. Декомпенсована СН. Вазоспастична стенокардія | БКК, які знижують ЧСС Препарати, які уповільнюють АV-провідність і впливають на синусовий вузол | ЦД ХОЗЛ |
| АК (верапаміл, дилтіазем) | Брадикардія. Порушення провідності. Зниження ФВ. Гіперплазія ясен | Низька ЧСС чи порушення серцевого ритму. Синдром слабкості синусового вузла (СССВ). Застійна СН. Низький АТ | Кардіодепресанти (ББА, флекаїнід) CYP З4-субстрати | |
| АК (дигідропіридини) | Головний біль. Набряк гомілок. Втомлюваність. Гіперемія. Рефлекторна тахікардія | Кардіогенний шок. Виражений аортальний стеноз. Обструктивна форма гіпертрофічної кардіоміопатії (ГКМП) | CYP З4-субстрати | |
| Івабрадин | Фотопсія. Головний біль та запаморочення. Брадикардія. ФП. Серцеві блокади | Низька ЧСС чи брадиаритмії. Алергія. Тяжкі захворювання печінки | Препарати, які подовжують Q–Т Макроліди Анти-ВІЛ (вірус імунодефіциту людини) та протигрибкові засоби | Тяжка ниркова недостатність |
| Нікорандил | Головний біль. Гіперемія. Запаморочення і загальна слабкість. Нудота. Гіпотензія. Виразки ШКТ і порожнини рота | Кардіогенний шок. СН. Низький АТ | Інгібітори фосфодіестерази-5 (силденафіл і подібні препарати) | |
| Триметазидин | Дискомфорт у шлунку. Нудота. Головний біль. Рухові (екстрапірамідні) розлади | Літній вік (>75 років). Помірна ниркова недостатність | Невідома | Хвороба Паркінсона. Тремор і рухові розлади. Тяжка ниркова недостатність |
| Ранолазин | Запаморочення. Констипація. Нудота. Подовження інтервалу Q–T | Цироз печінки | CYP З4-субстрати (дигоксин, симвастатин, циклоспорин) Препарати, які подовжують Q–T |
Примітка. Таблиця не дає вичерпної інформації щодо зазначених лікарських засобів. Для їх практичного використання необхідно ознайомитись із відповідними інструкціями для медичного застосування, затвердженими МОЗ України.
Предиктори ризику виникнення резистентності до лікування стабільної стенокардії напруження: часті напади стенокардії, стенозуючий атеросклероз КА, перенесений ІМ, тяжкі аритмії та блокади серця; виражена ГЛШ, лівого передсердя (ЛП), ПШ; зниження толерантності до фізичного навантаження; збільшення КСО та кінцево-систолічного розміру (КСР), КДО та кінцево-діастолічного розміру (КДР), зниження ФВ ЛШ до 40% за даними ехоКГ; приєднання тяжких супутніх захворювань внутрішніх органів (гіпертонічна хвороба, ХОЗЛ, хронічний гепатит, цироз печінки, хронічний гломерулонефрит, ЦД тощо); значне порушення мікроциркуляції; розвиток артеріальної гіпоксемії та гіпоксії, значна активація перекисного окиснення ліпідів (ПОЛ) і зниження антиоксидантної системи захисту (АОСЗ), підвищення агрегації тромбоцитів та еритроцитів тощо.
Схему лікування цих пацієнтів наведено в алгоритмі 2.5.
| Алгоритм 2.5. Лікування при рефрактерній формі стабільної стенокардії напруження Крок 1. Зменшення вираженості больового синдрому, потреби міокарда в кисні шляхом комбінованого застосування антиангінальних препаратів: ББА + АК + нітрати в оптимальних дозах. Крок 2. Профілактика тромбоутворень шляхом застосування прямих антикоагулянтів (гепарин, фраксипарин) або антиагрегантів (АСК, клопідогрель, абциксимаб) в оптимальних дозах. Крок 3. Підвищення клінічної ефективності антиангінальних препаратів шляхом комбінації антиішемічного засобу триметазидину (70 мг/добу) та іАПФ (периндоприл по 5–10 мг/добу, лізиноприл по 20–40 мг/добу). Крок 4. Продовження гіполіпідемічної терапії. Крок 5. У разі відсутності ефекту від лікування проводять агресивну кардіоваскулярну терапію: ТБКА, стентування, АКШ |
Наразі не існує переконливих даних, які би свідчили про те, що стентування КА покращує прогноз життя при стабільній стенокардії. Разом з тим якість життя суттєво покращується. АКШ подовжує як тривалість, так і якість життя.
При тривалому застосуванні нітратів виникає толерантність — поступове зникнення антиішемічного та гемодинамічного ефектів (відбувається звикання до препаратів). Толерантність найменш характерна для нітратів короткої дії. Постійний високий рівень нітратів у крові призводить до недостатнього впливу на рецептори гладком’язових клітин судинної стінки, а також до вичерпання запасів SH-груп, які забезпечують утворення кінцевого продукту біотрансформації нітратів — оксиду азоту. Ці фактори знижують реактивність судин і на 20% послаблюють вазодилативний ефект нітратів; суттєво знижується кровообіг у нирках.
Заходи щодо запобігання та усунення толерантності до нітратів:
- перерви у прийомі нітратів перорально (бажано, щоб тривалість періоду між прийомом нітратів становила 10–12 год щодоби). У зв’язку з тим що найбільша кількість епізодів ішемії виникає вранці, а другий пік ішемії припадає на післяобідній період (циркадний ритм ішемії міокарда), нітрати доцільно застосовувати зранку та в обід і не рекомендувати їх на ніч;
- призначення препаратів у вищих дозах (ефективність цього методу короткочасна, на декілька днів);
- комбіноване лікування нітратами у низьких дозах у поєднанні з ББА та іАПФ, які мають SH-групу (каптоприл, зофеноприл).
Таким чином, використання стандартів діагностики і лікування стабільної стенокардії, згідно з рекомендаціями доказової медицини, допоможе підвищити ефективність терапії та зменшити кінцеві точки (розвиток повторного ІМ, РСС, загальної і серцево-судинної смертності).
Помилки та необґрунтовані призначення препаратів за невиконання рекомендацій доказової медицини
Основні причини помилок у лікуванні при стабільній стенокардії:
1) недостатні знання та вміння діагностувати ІХС;
2) недостатні знання клінічної фармакології.
При лікуванні стабільної стенокардії не рекомендується:
- одночасно призначати похідні дигідропіридину та нітратів у зв’язку з можливістю виникнення тяжкої артеріальної гіпотензії (за незначним винятком);
- призначати нітрати, похідні дигідропіридину пацієнтам з ГКМП;
- застосовувати ББА в поєднанні з АК верапамілом (викликає різку гіпотензію, брадикардію, АV-блокади);
- призначати АК (за винятком амлодипіну і фелодипіну) при СН і вираженій скоротливій дисфункції ЛШ;
- призначати ББА, верапаміл чи дилтіазем при вираженій брадикардії, СССВ, АV-блокадах.
За даними метааналізу, застосування антиоксидантних вітамінів Е і β-каротину в різних популяціях не запобігає розвитку ССЗ. Отримані дані свідчать про недоречність широкого застосування вітаміну Е для лікування та профілактики ССЗ. Результати досліджень свідчать про те, що вітамін Е може послабити дію статинів.
- Ішемічна хвороба серця
- Стабільна ішемічна хвороба серця
- Гострий коронарний синдром
- Гострий коронарний синдром без елевації сегмента ST, нестабільна стенокардія, інфаркт міокарда без зубця Q
- Інфаркт міокарда




