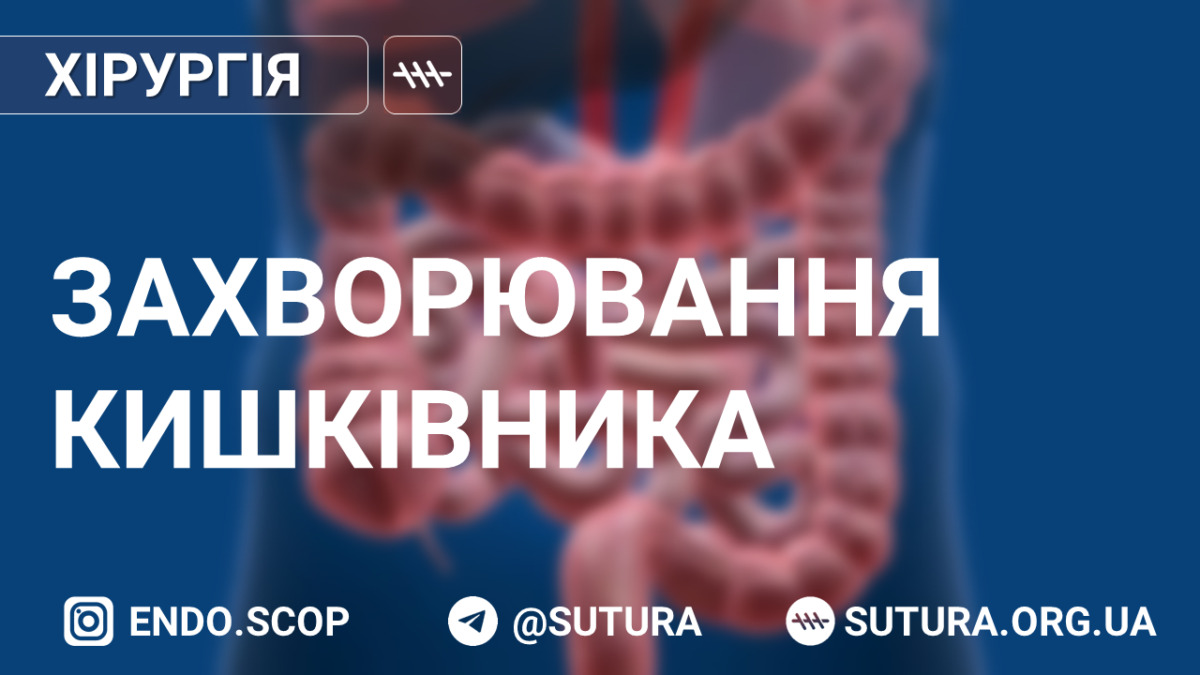
Синдром інтраабдомінальної гіпертензії
Останнім часом все більше уваги приділяється вивченню ролі внутрішньочеревного тиску (ВЧТ) при різних патологічних станах, у т.ч. не тільки повʼязаних з захворюваннями органів черевної порожнини. Це зумовлено тим, що підвищений внутрішньочеревний тиск негативно відображається на функції всіх органів і систем організму.
Встановлено, що на тлі інтраабдомінальної гіпертензії (ІАГ) знижується серцевий викид, обмежується легенева вентиляція, пригнічується функція нирок, порушується кровопостачання внутрішніх органів, що в кінцевому підсумку веде до розвитку поліорганної недостатності та зумовлює високу летальність.
Під внутрішньочеревним тиском розуміють усталений тиск у черевній порожнині. У нормі рівень ВЧТ у дорослих становить не більше 5-7 мм рт.ст. або 7-10 см вод.ст. (1 мм рт. ст. = 1,35951 см. вод. ст.).
У деяких випадках ВЧТ може бути істотно вищим, наприклад, при ожирінні III-IV ступеня, а також після планової лапаротомії. За рахунок скорочення і розслаблення діафрагми ВЧТ дещо збільшується і знижується при диханні.
Міжнародним товариством з абдомінального компартмент-синдрому (World Society of the Abdominal Compartment Syndrome – WACS) дано визначення ІГ – це стійке підвищення ВЧТ до 12 і більше мм рт. ст. (16 см вод.ст.), який реєструється як мінімум при трьох стандартних вимірах з інтервалом у 4-6 год. Дане визначення виключає реєстрацію коротких, нетривалих коливань ВЧТ, які не мають ніякого клінічного значення.
Класифікація інтраабдомінальної гіпертензії – ІАГ (WSACS, 2004):
І ступінь: ВЧТ – 12-15 мм рт. ст. (16-20 см вод.ст.)
ІІ ступінь: ВЧТ – 16-20 мм рт. ст. (21-27 см вод.ст.)
III ступінь: ВЧТ – 21-25 мм рт. ст. (28-34 см вод.ст.)
IV ступінь: ВЧТ > 25 мм рт. ст. (34 см вод.ст.)
ІГ є продромальною фазою розвитку синдрому інтраабдомінальної гіпертензії (СІАГ). У пацієнтів після планової лапаротомії тиск в черевній порожнині може досягати 13 мм рт. ст. без розвитку СІГ. При підвищенні ІАГ до 35 мм рт. ст. (48 см вод.ст.) і вище синдром інтраабдомінальної гіпертензії (CIA) розвивається в 100% випадків з високим ризиком летального результату.
Синдром інтраабдомінальної гіпертензії, або Abdominal Compartment Syndrome (ACS) – це симптомокомплекс, що розвивається внаслідок стійкого підвищення тиску в черевній порожнині понад 20 мм рт. ст. (27 см вод.ст.) із або без АПТ < 60 мм рт. ст. і характеризується розвитком поліорганної недостатності /дисфункції.
СІГ є частим супутником перитоніту, особливо поширеного гнійного, але далеко не завжди сприймається як причина розвитку і/або прогресування поліорганної недостатності.
Разом з тим, на тлі вираженої інтоксикації, а також змін на клітинному і мікроциркулярному рівнях, що спостерігаються при перитоніті, саме інтраабдомінальна гіпертензія сприяє розвитку таких ускладнень, як дихальна недостатність, зниження серцевого викиду, оліго- і/або анурія, метаболічний ацидоз та ін.
Відсутність настороженості й недооцінка проблеми СІГ сприяє тому, що формування поліорганних порушень у хворих з важким перитонітом помилково розцінюється як наслідок інтоксикації та гіповолемії.
Летальність при розвитку СІГ сягає 70 %. Це пояснюється тим, що інтраабдомінальна гіпертензія сприяє розвитку поліорганної недостатності і, як правило, виникає на тлі вже наявних тяжких пошкоджень і вираженої інтоксикації.
Дані про частоту розвитку СІАГ сильно варіюють. Так при панкреонекрозі, перитоніті у 30% пацієнтів спостерігається значне підвищення внутрішньочеревного тиску, проте СІГ розвивається у 5-6 %. При цьому у хворих після лапаротомії з приводу закритої травми живота частота розвитку СІГ досягає 15 %.
За походженням виділяють:
- Первинний СІАГ, який є наслідком патологічних процесів, що розвиваються безпосередньо в самій черевній порожнині (абдомінальна травма, розрив аневризми черевного відділу аорти, гемоперитонеум, гострий панкреатит, поширений перитоніт, черевна гематома тощо).
- Вторинний СІАГ характеризується присутністю підгострої або хронічної ІГ, причиною якої стала екстраабдомінальна патологія (сепсис, “капілярний витік”, великі опіки або інші стани, які потребують масивної інфузійної терапії; найчастіше розвивається у пацієнтів з опіками).
- Поворотний СІАГ (третинний) являє собою повторну появу симптомів, характерних для СІАГ, на тлі розрішення картини раніше виниклого первинного або вторинного СІГ. Часто цей
стан називають “феномен другого удару”. Поворотний СІГ може розвиватися на тлі наявності у хворого “відкритого живота” (open abdomen compartment syndrome) або після раннього зашивання черевної порожнини наглухо (ліквідації лапаростоми). Третинний СІАГ характеризується достовірно високою летальністю.
У розвитку СІГ відіграють роль сприятливі фактори.
Фактори, що сприяють зниженню еластичності передньої черевної стінки:
- штучна вентиляція легень, особливо при опорі дихального апарату;
- використання ПТКВ (РЕЕР) або наявність ауто-ПТКВ (auto-PEEP);
- плевропневмонія;
- надлишкова маса тіла;
- пневмоперитонеум;
- зашивання передньої черевної стінки в умовах ї високого натягу;
- натяжна пластика гігантських вентральних гриж;
- положення тіла на животі;
- грубі опікові деформації черевної стінки.
Фактори, що сприяють збільшенню вмісту черевної порожнини:
- парез шлунка, патологічний ілеус;
- пухлини черевної порожнини;
- вагітність;
- аневризма черевного відділу аорти;
- набряк або гематома заочеревинного простору.
Фактори, що сприяють накопиченню патологічної рідини або газу в черевній порожнині:
- асцит;
- панкреатит;
- перитоніт;
- гемоперитонеум;
- пневмоперитонеум.
Фактори, що сприяють розвитку “капілярного витоку”:
- ацидоз (рН нижче 7,2);
- гіпотермія (температура тіла нижче 33 °С);
- масивна гемотрансфузія (більше 10 одиниць еритроцитної маси на добу);
- коагулопатія (тромбоцити менше 50000 × 109 або АЧТЧ у 2 рази вище норми, або МНО вище
1,5); - сепсис;
- бактеріємія;
- масивна інфузійна терапія (більше 5 л колоїдів або кристалоїдів за 8-10 год з капілярним набряком і рідинним балансом);
- великі опіки (понад 25% площі тіла).
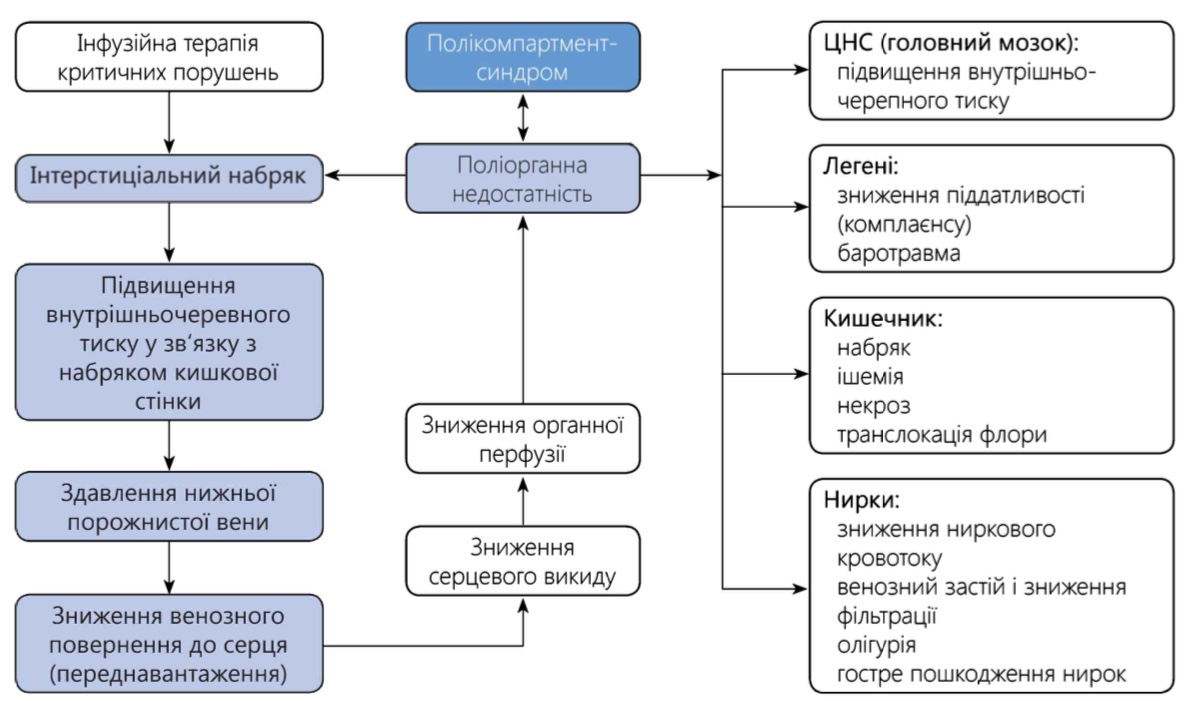
Схематично патогенез СІГ представлений на рисунку 2.1.
Вплив інтраабдомінальної гіпертензії на систему кровообігу:
- значно знижується венозне повернення за рахунок прямої дії підвищеного внутрішньочеревного тиску на нижню порожнисту вену;
- підвищується тиск в грудній порожнині за рахунок зміщення діафрагми, що ще більшою мірою посилює зниження венозного повернення;
- відбувається механічна компресія серця і магістральних судин і, як наслідок, підвищується тиск у системі малого кола кровообігу;
- прогресивно знижується СВ навіть незважаючи на компенсаторну тахікардію; при цьому показники артеріального тиску можуть не змінюватися або варіювати в широких межах;
- підвищується загальний периферичний опір судин – його величина прямо пропорційна величині ІАГ, що зумовлено як прямим механічним здавленням переважної більшості судин, так і відповідною рефлекторною реакцією на зниження СВ;
- підвищується ЦВТ і тиск заклинювання легеневої артері, поряд зі зниженням кінцевого діастолічного обʼєму і підвищенням кінцевого діастолічного тиску; причому зміни цих показників достовірно не відображають ні стан серцевої діяльності, ні ступінь гіповолемії.
Більш інформативними методами діагностики центральної гемодинаміки в даній ситуації є вимі-рювання СВ, серцевих обʼємів та індексів.
Вплив інтраабдомінальної гіпертензії на систему дихання:
- зʼявляється задишка, яка часто є першим про-явом ІГ при перитоніті, не ускладненому поліорганними порушеннями;
- підвищується внутрішньогрудний тиск за рахунок зміщення діафрагми в бік грудної порожнини, в результаті чого знижуються дихальний обʼєм і функціональна залишкова ємність легень, колабуються альвеоли базальних відділів, зʼявляються ділянки ателектазів.
Перелічені зміни призводять до наступних порушень:
- змінюються вентиляційно-перфузійні відношення в бік збільшення шунта;
- розвиваються гіпоксемія, гіперкапнія і респіраторний ацидоз;
- збільшується піковий інспіраторний тиск;
- збільшується внутрішньоплевральний тиск;
- знижується динамічний комплаєнс.
У звʼязку зі значними порушеннями біомеханіки дихання (залучення допоміжної мускулатури, збільшення “кисневої вартості” дихання), швидко розвивається гостра дихальна недостатність. Тому дана категорія хворих вже на початкових етапах потребує проведення респіраторної підтримки.
Вплив інтраабдомінальної гіпертензії на систему сечовиділення насамперед полягає в зниженні ниркового кровотоку і швидкості гломерулярної фільтрації з подальшим розвитком гострої ниркової недостатності. Певну роль у цьому відіграє гормональне зрушення: підвищення секреції антидіуретичного гормону, реніну й альдостерону.
Вважається, що зниження гломерулярної філь-трації настає при ІАГ > 10-15 мм рт. ст. (14-20 см вод. ст.), а анурія розвивається при ІАГ > 30 мм рт. ст. (41 см вод. Ст.).
Слід зазначити, що після розрішення СІГ гемодинамічні показники і функція зовнішнього дихання відновлюються досить швидко, а ниркові порушення зберігаються протягом тривалого часу.
Вплив інтраабдомінальної гіпертензії на орга-ни черевної порожнини:
- знижується спланхнічний кровотік;
- порушується мікроциркуляція, що веде до тромбоутворення в дрібних судинах, ішемії кишкової стінки, її набряку з розвитком внутрішньоклітинного ацидозу; це призводить до транссудації та ексудації рідини, що посилює ІАГ, утворюючи порочне коло. Дані порушення відзначаються при підвищенні тиску вже до 15 мм рт. ст. (20 см вод.ст.);
- розвивається ішемія кишкової стінки (при збільшенні внутрішньочеревного тиску до
25 мм рт. ст. або 34 см вод.ст.), що призводить до транслокації бактерій та їх токсинів у мезентеріальний кровотік і лімфовузли; - порушується лімфодинаміка по грудній лімфатичній протоці (при внутрішньочеревному тиску 30 мм рт. ст. або 41 см вод.ст.), що призводить до подальшого збільшення інтраабдомінального обʼєму і, як наслідок, АГ;
- відбувається додаткова секвестрація рідини в інтерстиціальний простір, набряк кишечника і підвищення ІАГ за рахунок зниження СВ, олігурії, а також масивної інфузійної терапії, чим і замикається порочне коло;
- знижується доставка кисню на тканинному рівні, що проявляється гіпоксією, ішемією, розвитком анаеробного шляху метаболізму. В результаті виділяються біологічно активні речовини, що ушкоджують ендотелій, медіатори неспецифічного запалення і вазоактивні субстанції збільшується проникність ендотелію, набряк інтерстицію, що посилює ішемію і трансмембранний транспорт та несприятливо відображається на спроможності анастомозів і загоєнні післяопераційних ран. Ці неспецифічні зміни розвиваються набагато раніше від клінічно помітних проявів СІГ.
Слід зазначити, що після досягнення ІАГ 20 мм рт. ст. (27 см вод.ст.) і більше знижується портальний кровотік, а отже й метаболізм, у тому числі й лікарських препаратів.
Вплив інтраабдомінальної гіпертензії на центральну нервову систему:
- підвищується внутрішньочерепний тиск, найімовірніше за рахунок утрудненого венозного відтоку по яремних венах внаслідок підвищеного внутрішньогрудного тиску і ЦВТ, а також впливу ІГ на ліквор через епідуральне венозне сплетення;
- знижується перфузійний тиск головного мозку.
Наведені дані про вплив ІГ на різні органи і системи організму свідчать про те, що СІАГ є однією з основних причин розвитку системної та органної декомпенсації у пацієнтів, які перебувають у критичних станах.
Наявність перитоніту і повʼязані з ним порушення гомеостазу багато в чому прискорюють розвиток СІГ. При цьому тяжкість перебігу і ймовірність розвитку ПОН збільшуються пропорційно швидкості наростання ІГ. Слід памʼятати, що первинний СІГ може розвинутися протягом кількох годин, а частота розвитку СІГ прямо пропорційна ступеню підвищення тиску в черевній порожнині.
Моніторинг інтраабдомінальної гіпертензії відіграє значну роль в результаті лікування хворого. Тиск у черевній порожнині можна вимірювати при лапароскопц, перитонеальному діалізі або при наявності лапаростоми (прямий метод). На сьогодні прямий метод вважається найточнішим, проте його використання обмежене через високу вартість.
У звʼязку з цим значно більшого поширення набули непрямі методи визначення внутрішньочеревного тиску: через порожнину матки, шлунка, у стегновій вені, нижній порожнистій вені, прямій кишці і сечовому міхурі. Найпростішим і найдоступнішим способом визначення і моніторингу ІГ є вимірювання тиску всередині сечового міхура, що часто є методом вибору при діагностиці СІАГ.
Нині розроблено спеціальні закриті системи для вимірювання внутрішньоміхурового тиску. Деякі з них підключаються до датчика інвазивного тиску і монітора (AbVizer™), інші є повністю готовими до використання без додаткових інструмен-тальних аксесуарів (Unometer™ Abdo-Pressure™Unomedical). Останні вважаються кращими, оскіль-ки набагато простіші у використанні і не вимагають додаткової дорогої апаратури.
Unometer™ AbdoPressure™ являють собою стерильну закриту систему, яка включає уриметр, вимірювальну частину, що складається з градуйованої трубки з кроком вимірювання 1 мм рт. ст. і вбудованого в її верхню частину гідрофобного антибактеріального повітряного фільтра, через який в момент вимірювання ВЧТ в систему проходить очищене повітря.
Внутрішньочеревний тиск вимірюють у горизонтальному положенні пацієнта на спині в кінці видиху при відсутності мʼязового напруження передньої черевної стінки (пацієнт повинен бути адекватно знеболений, особливо в післяопераційному періоді), що за рахунок розслаблення мʼязів передньої черевної стінки дозволяє отримати найточніші цифри ВЧТ.
Для вимірювання використовують звичайний сечовий катетер Фолея, через який усередину порожнього сечового міхура рекомендується вводи-ти не більше 25 мл теплого стерильного фізіологічного розчину.
Надалі для вимірювання тиску використовують прозорий капіляр і лінійку. Нульове значення шкали слід встановлювати на рівні середньої пахвової лінії (рис. 2.2). До недоліків методу слід віднести необхідність при кожному вимірюванні збирати систему заново, що передбачає високий ризик розвитку висхідної інфекції сечовивідних шляхів. У звʼязку з цим для визначення ВЧТ краще використовувати описані вище спеціальні закриті системи.
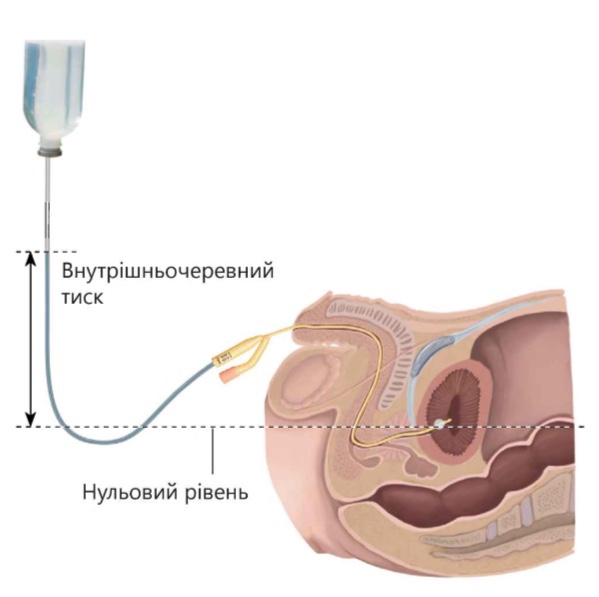
Протипоказанням до застосування цього методу є пошкодження сечового міхура, а також здавлення сечового міхура гематомою або пухлиною. У цих випадках ІГ оцінюють, вимірюючи внутрішньошлунковий тиск.
У пацієнтів з підозрою на СІГ вимірювання внутрішньочеревного тиску слід виконувати кожні 2-4 год. При цьому доцільно визначати перфузій-ний тиск черевної порожнини, який багато в чому визначає тяжкість і прогноз СІАГ, а також фільтра-ційний градієнт.
Абдомінально-перфузійний тиск (АПТ). Показник АПТ є найбільш точним предиктором вісцеральної перфузії і служить одним з параметрів припинення масивної інфузійної терапії у важких хворих. Рівень АПТ нижче 60 мм рт. ст. безпосередньо корелює з виживанням пацієнтів з ІАГ і СІАГ.
Абдомінально-перфузійний тиск визначається за формулою: АПТ = ATсер – ВЧТ
Фільтраційний градієнт (ФГ). На зміну ВЧТ найшвидше реагує функція нирок і сечовиділення, а не артеріальний тиск, і як наслідок саме олігурія є одним з перших візуальних факторів розвитку ІАГ. У звʼязку з цим перфузійний тиск нирок і нирково-фільтраційний градієн виділені як ключові в розвитку ниркової недостатності при ІАГ, а розрахунок фільтраційного градієнта дозволяє на ранніх термінах встановити розвиток органної недостатності при ІГ. Фільтраційний градієнт визначається за формулою: ФГ = ATсер– 2 х ВЧТ
Показання до моніторингу ВЧТ:
І. Масивна інфузійна терапія:
• сепсис.
ІІ. Патологічні процеси черевної порожнини або заочеревинного простору:
- асцит;
- гігантські пухлини черевної порожнини і заочеревинного простору;
- великі гематоми заочеревинного простору і передньої черевної стінки.
III. Хірургія:
- масивна інтраопераційна інфузійна терапія (понад 5 л);
- поширений перитоніт;
- гостра кишкова непрохідність;
- гострий некротичний панкреатит;
- защемлена грижа;
- зашивання лапаротомної рани в умовах натягу її країв;
- розрив черевного відділу аорти;
- гостре порушення мезентеріального кровообігу;
- кардіохірургічні операції торакоабдомінальним доступом;
- гастрошизис / омфалоцеле.
IV. Травма:
- хірургія за принципами “damage control surgery”;
- важка поєднана травма, яка потребує масивної інфузійної терапії (більше 5 л колоїдів або більше 4 ОД еритроцитної маси протягом 8 год);
- опікова деформація передньої черевної стінки.
Критерії діагностики СІАГ. Діагноз СІАГ імо-вірний при ІАГ ≥ 15 мм рт. ст. (20 см вод.ст.), ацидозі в поєднанні з наявністю одної або кількох з перерахованих ознак:
- гіпоксемія;
- підвищення ЦВТ і/або тиск заклинювання легеневої артерії;
- гіпотонія та / або зниження серцевого викиду;
- олігурія;
- поліпшення стану після декомпресії.
Лікування синдрому інтраабдомінальної гіпертензії
Найважливішим завданням є профілактика та рання діагностика СІГ ще до початку розвитку ПОН, що можливо тільки за умови постійного моніторингу ВЧТ у пацієнтів групи ризику розвитку СІАГ.
Зниженню внутрішньочеревного тиску сприяє своєчасна стимуляція порушеної моторної функції шлунково-кишкового тракту після лапаротомії і/ або травми живота, зондова декомпресія кишечника, епідуральна анестезія, киснева підтримка і т.д.
Хірургічна декомпресія є єдиним ефективним методом лікування СІГ. Вона достовірно знижує летальність і за життєвими показаннями може бути виконана навіть у палаті інтенсивної терапії. Слід зазначити, що без проведення хірургічної декомпресії – радикального лікування СІАГ – летальність сягає 100%. При декомпресійній лапаротомії / релапаротомії, зробленій через 3-6 год від появи перших ознак СІГ, летальність сягає 20%, а в пізні-ші терміни – 40-70%.
У даний час пропонується наступний алгоритм лікування (рис. 2.3):
- при І ступені ІГ – адекватна інфузійна терапія і спостереження;
- при II ступені ІГ – продовження терапії і спостереження, декомпресивна лапаротомія здійснюється при появі клінічної картини СІАГ;
- при III ступені ІАГ – декомпресивна лапаротомія, лапаростомія і продовження інтенсивної
терапи; - при IV ступені ІАГ – негайна декомпресія і реанімаційні заходи.
У пацієнтів з наявністю вільної рідини в черевній порожнині, особливо при вторинному CIA, першим етапом доцільно виконати пункцію черевної порожнини, лапароцентез або лапароскопію з евакуацією рідини і дренуванням черевної порожнини, і лише за відсутності результату – проводити лапаротомію.
Декомпресивна лапаротомія як операція вибору дозволяє значно знизити летальність у пацієнтів із CIA. Її рекомендують виконувати не тільки в умовах операційної, а й у ВІТ.
Після виконання декомпресії за допомогою лапаротомії / релапаротомії вирішується питання про тип зашивання передньої черевної стінки. Розроблено ряд методик декомпресійного зашивання черевної порожнини та її тимчасової пластики адсорбуючими сітками або латками (Gore-Tex, Marlex, Prolene й ін.), які збільшують розмір черевної по-рожнини, зменшуючи тим самим внутрішньочеревний тиск.
Наявність множинних фібринозно-гнійних накладень, що не видаляються, та формування абсцесів, підвищення мангеймського індексу перитоніту понад 20 балів і/або індексу черевної порожнини понад 13 балів вважається показанням до етапних планових санацій черевної порожнини.
До першочергових заходів належать:
- швидкий і найменш травматичний багаторазовий доступ у черевну порожнину;
- необхідні умови для повноцінної ревізії і санації всіх її відділів,
- захист органів черевної порожнини і підтримання їх фізіологічного інтраабдомінального
положення; - мінімальний ризик розвитку гнійних ускладнень з боку лапаротомної рани і передньої черевної стінки:
- можливість подальшої повної реконструкції передньої черевної стінки;
- декомпресію й адекватне дренування черевної порожнини.
Для вирішення перелічених завдань застосовується лапаростома, яка може бути як повною або відкритою (не передбачає взагалі будь-якої фіксації країв операційної рани між операціями), так і частковою (передбачає часткове зведення країв рани). Зокрема, для виконання останньої запропоновано безліч складних спеціальних пристроїв, що забезпечують програмований доступ у черевну порожнину.
Переваги лапаростомії перед програмованою релапаротомією полягають у тому, що при використанні цього методу лікування можливе здійснення постійного контролю за станом черевної порожнини і проведення її санації.
Більш того, при лапаростомії не підвищується тиск у черевній порожнині (на відміну від програмованої релапаротомії), що сприяє поліпшенню мікроциркуляції в кишковій стінці і ранньому відновленню її моторної функції, а також сприяє кращій аерації черевної порожнини, що істотно при наявності анаеробного компонента мікрофлори.
Найбільш популярним варіантом, що забезпечує програмований доступ у черевну порожнину, є зведення краів рани за допомогою вентрофіл (B. Braun-Dexon GmbH). Вентрофіли фіксують до черевної стінки окремими вузловими швами через усі шари, на відстані 4-5 см від краю рани. Дозоване зведення країв здійснюють лавсановими шнурами, проведеними через вентрофіли.
Рідше застосовують застібки типу “блискавка” та “репʼях” (Velcro) з їх фіксацією безперервним лавсановим швом до країв апоневрозу, рідше – до шкірних країв рани. Разом з тим, досвід застосування цих та інших зближувальних пристроїв показав ряд недоліків – високу травматичність, складність і в деяких випадках – ненадійність даних методів фіксації.
Показання до часткової лапаростоми (і програмованих санацій черевної порожнини):
- будь-яка стадія поширеного перитоніту з явищами поліорганної недостатності;
- будь-яка стадія поширеного перитоніту з масивним каловим забрудненням черевної порожнини;
- анаеробний перитоніт;
- евентрація в гнійну рану при поширеному перитоніті;
- множинні абсцеси черевної порожнини з піогенними капсулами, а також формування абсцесів або товсті нашарування фібрину, інтимно спаяні з серозною оболонкою органів і не видалені під час промивання черевної порожнини;
- неусунене джерело перитоніту;
- неспроможність швів анастомозів з перитонітом;
- велика ймовірність неспроможності швів анастомозів на тлі поширеного перитоніту;
- неможливість звести краї лапаротомної рани без підвищення внутрішньочеревного тиску, що перевищує допустимі межі;
- великі дефекти черевної стінки, що перешкоджають закриттю абдомінальної рани без надмірного натягу;
- внутрішньочеревний тиск більше 20 мм рт. ст. (27 см вод.ст.);
- АПТ < 60 мм рт. ст.
Показання до повної лапаростоми або відкритого ведення черевної порожнини:
- ознаки анаеробного інфікування черевної порожнини або заочеревинного простору;
- гнійно-некротичне ураження рани або флегмона передньої черевної стінки;
- прогресування СІАГ.
Техніка накладення лапаростоми. Накладення лапаростоми може бути як завершальним етапом операції з приводу поширеного гнійного перитоніту, гострої декомпенсованої непрохідності кишечника і т.д., так і первинним втручанням, наприклад, при гострому асептичному некротичному панкреатиті в поєднанні з великою інфільтрацією заочеревинної клітковини і вираженим парезом кишечника. Різниця полягає лише в тому, що в першому випадку накладенню лапаростоми передують етапи ліквідації причини перитоніту або гострої непрохідності кишечника і санація черевної порожнини, а в другому – лапаростомія накладається для зниження внутрішньочеревного тиску і не передбачає виконання будь-якого втручання на органах черевної порожнини. Загальною є лише необхідність виконання зондової декомпресії кишечника перед завершенням операції.
Надалі великий сальник фіксують у підчерев’ї. Із перфорованої поліетиленової плівки, приготовленої заздалегідь, вирізується шматок, який дещо перевищує розміри передньої черевної стінки даного хворого. Плівка укладається на петлі кишечника і заводиться якнайдалі в пологі місця черевної порожнини: малий таз, бічні канали, піддіафрагмальний простір. У верхньому кутку рани плівку фіксують до очеревини або апоневрозу кількома вузловими швами. По можливості ретельно розправляють складки плівки. Після правильного укладання органи черевної порожнини виявляються значною мірою загорнутими в плівку
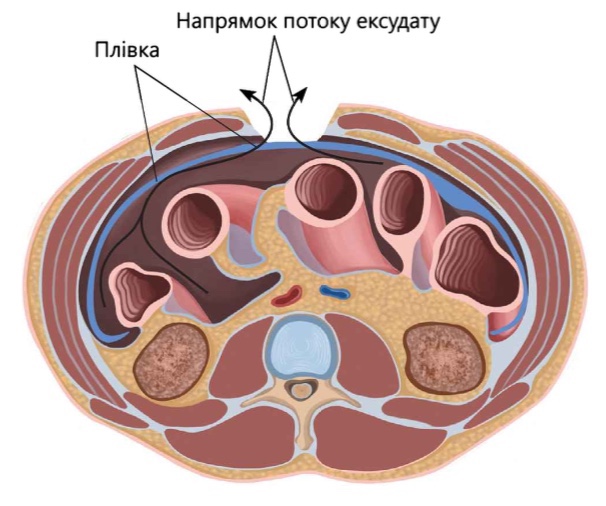
На лапаротомну рану за допомогою великої ріжучої голки через усі шари черевної стінки на відстані 3-5 см від краю рани і 7-8 см один від од-ного накладаються поодинокі або П-подібні шви довгими міцними нитками. Зазвичай накладають 3-4 шви.
Обережним натягуванням ниток краі рани дещо зводяться так, щоб діастаз між ними становив приблизно 3-5 см, а петлі кишечника не про-лабували, після чого шви завʼязуються на “бантики” із залишенням довгих кінців ниток. Поверх ниток у рану черевної стінки вкладаються марлеві серветки з антисептиком або водорозчинними мазями, потім накладається звичайна повʼязка. Зведення країв рани черевної стінки має здійснюватися під обовʼязковим контролем внутрішньочеревного тиску. Внутрішньочеревний тиск не повинен перевищувати 8-10 мм рт. ст. або 11-14 см. вод.ст.!
При необхідності ревізії або санації черевної порожнини “бантики” розв’язують, шви розпускають, кінці ниток фіксують затискачами, самі нитки зміщують догори і донизу до кутів операційної рани, краї лапаротомної рани обережно розводять, поліетиленове покриття з марлею видаляють.
Після закінчення маніпуляцій нове покриття поміщають на місце, шви знову зводять із залишенням необхідного за станом кишечника просвіту між краями лапаротомної рани і завʼязують на “бантики”. Для попередження евентрації в цих випадках можна використовувати бандаж.
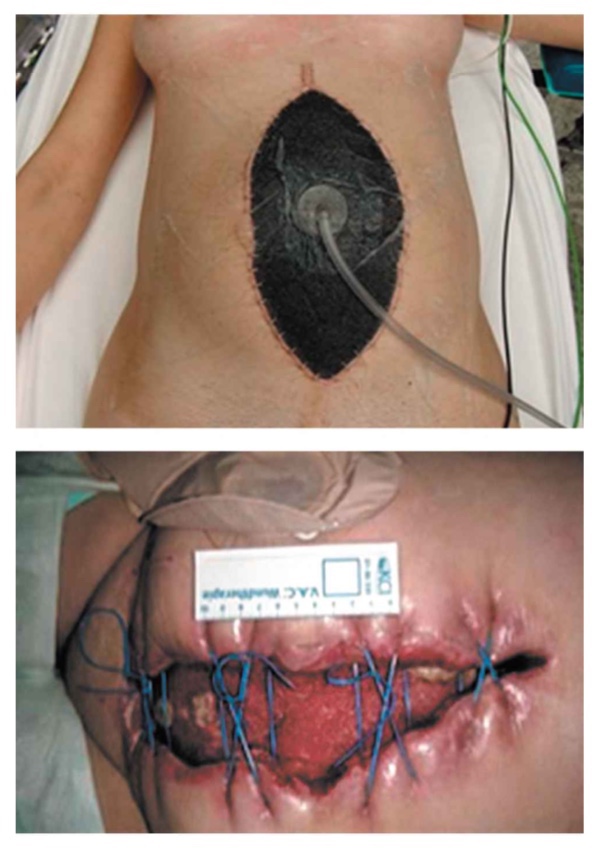
При відкритому способі ведення черевної порожнини, зокрема при лікуванні поширеного гнійного перитоніту, ефективним є використання вакуумної терапії (рис. 2.5). Завдяки застосуванню локального негативного тиску досягається швидше очищення черевної порожнини і зменшення набряку внутрішніх органів, активізуються репаративні процеси в рані, що у свою чергу дозволяє зменшити число етапних санацій черевної порожнини.
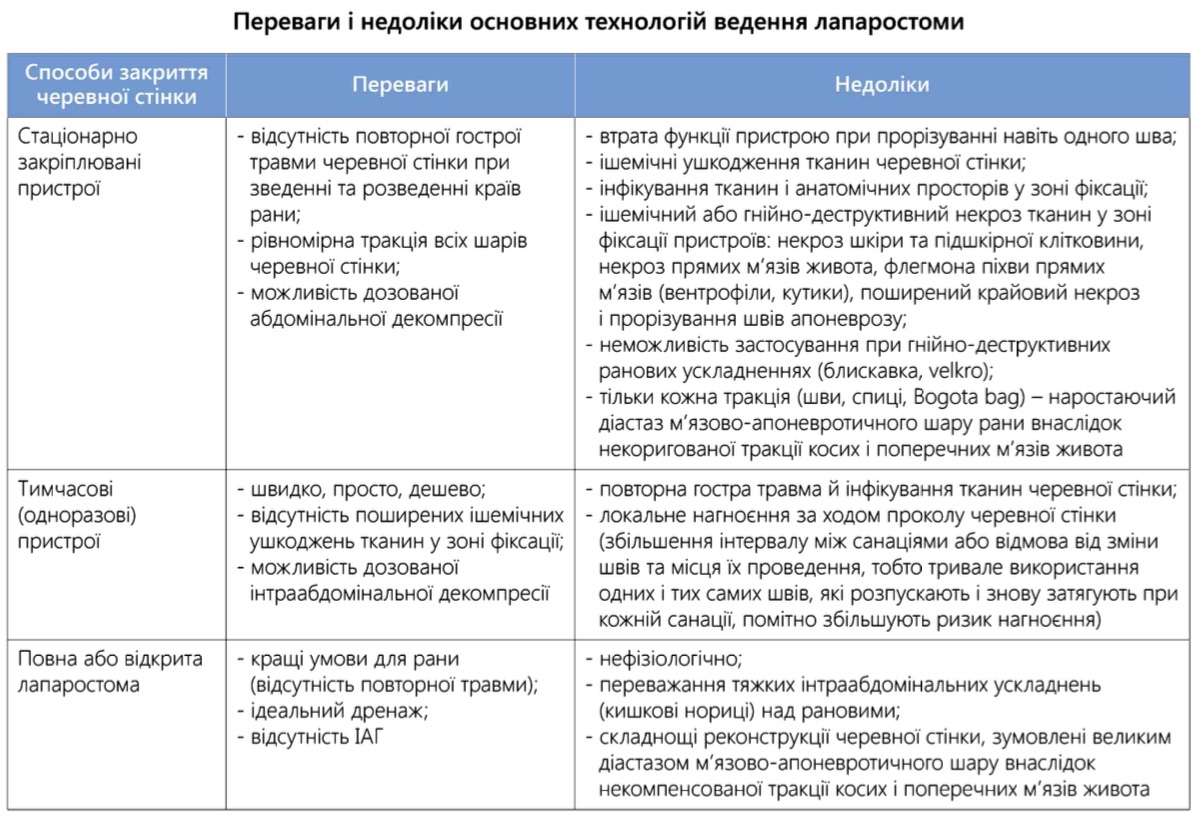
Переваги та недоліки різних способів закриття рани черевної стінки. При невеликому числі планованих етапних втручань (не більше 4) і відсутності гнійного ураження лапаротомної рани до початку етапного лікування будь-який метод фіксації країв рани забезпечує позитивний результат і, як правило, не веде до виникнення важких ускладнень.
Зі збільшенням числа етапних операцій, тобто залежно від інтенсивності й тривалості експлуатації тих чи інших пристроїв і методів, загроза ранових ускладнень зростає, при цьому їх характер і тяжкість мають особливості, повʼязані з типом застосовуваних пристроїв і методів ведення лапаростоми.
Однак загальний для всіх способів механізм пошкодження – ішемія та інфікування тканин черевної стінки – залишається незмінним. У цілому переваги та можливі недоліки основних технологій ведення лапаростоми, з точки зору ризику ранових ускладнень та очікуваного ефекту лікування перитоніту – дренажної і декомпресійної функції лапаростоми – представлені в таблиці 2.1.
Закриття рани черевної стінки. Найскладнішою проблемою, яка супроводжується значним підвищенням ВЧТ, є виконання останнього етапу – закриття лапаротомної рани. Основною вимогою є те, що остаточне зашивання рани черевної стінки можливе лише при показниках ВЧТ, що виключають розвиток СІГ у післяопераційному періоді.
Ідеальним є пошарове відновлення цілісності черевної стінки. Для цього може бути використане чергування П-подібних і вузлових швів апоневрозу в поєднанні з рідкими шкірними швами за Донатті. Найчастіше навіть при хорошому стані країв рани на шкіру накладають відстрочені шви. При необхідності окремі ділянки черевної порожнини й заочеревинного простору дренуються через додаткові розрізи.
Ускладнення декомпресії черевної порожнини. Поряд з багатьма позитивними ефектами (нормалізація гемодинаміки, дихання тощо), декомпресія черевної порожнини може провокувати й різні важкі ускладнення, запобігання яких є одним із паралельних завдань. Прогнозовані ускладнення декомпресії:
- гіпотонія (повʼязана з некоригованою гіповолемією);
- асистолія (зумовлена реперфузією і потраплянням у кровотік великої кількості проміжних продуктів метаболізму, наприклад, аденозину);
- тромбоемболія легеневої артерії (у звʼязку з уповільненням кровотоку і схильністю до
тромбоутворення).
Ускладнення відкритого ведення черевної порожнини. Як і будь-який хірургічний спосіб лікування, відкритий метод ведення черевної порожнини може супроводжуватися розвитком тих чи інших ускладнень. До найчастіших відносять:
- нагноєння післяопераційної рани;
- формування кишкових нориць на тлі етапного лікування;
- рання спайкова кишкова непрохідність;
- післяопераційний парез кишечника;
- формування післяопераційних вентральних гриж.
Назоінтестинальна інтубація і детоксикація – найважливіший етап лікування пацієнтів з інтраабдомінальною гіпертензією, обумовленою розлитим гнійним перитонітом, гострим інфікованим некротичним панкреатитом, гострою кишковою непрохідністю та ін. (рис. 2.6). Для цього використовують спеціальні інтестинальні зонди різної конструкції (в т.ч. і двопросвітні).
Особливу важливість має дренування початкового відділу тонкої кишки на протязі 50-70 см. При цьому для повноцінного дренування шлунка і запобігання регургітації необхідний окремий канал зонда, який закінчується в шлунку.
Застосування тільки розвантажувальних стом, що накладаються для декомпресії шлунково-кишкового тракту, наприклад, в умовах поширеного перитоніту, вважається неадекватним лікувальним заходом.
За способом уведення декомпресійного зонда виділяють:
- закритий інтестинальний шлях введення зонда (через ніс) – застосовується в більшості випадків (протипоказанням є дихальна недостатність);
- відкритий через гастростому, апендикостому, цекостому, єностому (показання – дихальна недостатність, виконання операції під епідуральною анестезією).
За рівнем уведення декомпресійного зонда виділяють:
- проксимальну (антеградну) інтубацію і декомпресію;
- дистальну (ретроградну) анально-інтестинальну інтубацію і декомпресію.
Інтестинальний зонд насамперед виконує декомпресійну і каркасну функції, а також може використовуватися для фракційного або постійного кишкового лаважу.
Контроль положення зонда обʼєктивно можна оцінити тільки під час операції. Це дуже важливо, оскільки дозволяє судити про потенційну можливість зонда в тій чи іншій конкретній ситуації, що залежить від стану кишечника, характеристики самого зонда тощо, в подальшому виконанні “покладених” на нього функцій. У звʼязку з цим при перитоніті контроль ефективності евакуації вмісту і лаваж кишечника доцільно починати відразу після остаточної установки зонда (рівномірне заповнення кишки при введенні та вільна евакуація) і контролювати при кожній санації в разі етапного лікування.
При перитоніті перевагу слід віддавати тотальній інтестинальній інтубації з проведенням зонда в термінальний відділ клубової кишки. Однак необхідно памʼятати про те, що чим довший зонд, тим “коротша” його ефективність у дренуванні всіх інтубованих відділів кишки. Тому довгий зонд у кращому випадку виконує лише свою каркасну функцію.
Двопросвітні зонди певною мірою дещо надійніші і зручніші, однак чим більше каналів у трубці обмеженого діаметра, тим менший їх просвіт, а отже, й ефективність евакуації кишкового вмісту.
У післяопераційному періоді адекватне виконання функцій інтестинального зонда вимагає постійного догляду (промивання) і корекції положення (зміщення), особливо при необхідності тривалої інтубації.
Помилки при виконанні інтубації кишечника:
- неправильна установка:
- перегини зонда, що перекривають його
просвіт; - відсутність перфорацій зонда в шлунку;
- наявність перфорацій у стравоході або ротоглотці.
- перегини зонда, що перекривають його
- поганий зонд:
- занадто мʼякий або надмірно термолабільний матеріал;
- недостатня кількість або діаметр перфорацій;
- надмірний або недостатній діаметр зонда.
- неправильний догляд:
- обтурація зонда кишковим вмістом (промивання однопросвітного зонда, якщо обтурація нижче верхнього отвору не допомагає);
- надактивна аспірація по зонду, відсутність корекції положення зонда при тривалій інтубації, що веде до пошкодження слизової оболонки кишки.
Ускладнення інтубації кишечника:
- пролежні, кровотечі, перфорації;
- порушення топічної мікроекології кишечника;
- аспірація кишкового вмісту в трахеобронхіальне дерево (синдром Мендельсона);
- синдром “реперфузії” (виникає при швидкому спорожненні ектазованої тонкої і/або товстої кишки на тлі тривалої “низької” тонкокишкової непрохідності або при вираженому парезі кишечника; клінічні прояви відповідають гострому септичному шоку.
Протипоказання до виконання назоінтес-тинальної інтубації:
- технічні труднощі при установці зонда, обумовлені анатомічними особливостями (звуження або викривлення носових ходів, деформація пілороантрального відділу, дванадцятипалої або тонкої кишки в зоні звʼязки Трейтца);
- виражена інфільтрація стінки кишки – травма перевищує ефект;
- крайня тяжкість стану хворого за умови вибору етапного лікування перитоніту.
Витягування назогастроінтестинального декомпресійного зонда здійснюється після відновлення стійкої перистальтики і самостійного випорожнення на 3-5 добу.
Зонд, встановлений в тонку кишку через гастростому або ретроградно, видаляється дещо пізніше – на 4-6 добу, а введений в кишку з каркасною метою при гострій спайковій кишковій непрохідності (при небезпеці розвитку ранньої спайкової кишкової непрохідності) – на 7-8 добу.
Інфузійна терапія
Наявність і ступінь вираженості гіповолемії у пацієнтів з ІАГ звичайними методами встановити практично неможливо. Тому інфузія повинна проводитися з обережністю, з урахуванням можливого набряку ішемізованого кишечника і ще більшого підвищення інтраабдомінального тиску.
При підготовці хворого до хірургічної декомпресії з метою попередження гіповолемії рекомендується інфузія кристалоїдів. Відновлення темпу сечовиділення, на відміну від гемодинамічних і респіраторних порушень, навіть після декомпресії настає не відразу, і для цього може знадобитися досить тривалий час. У цей період доцільне використання детоксикації екстракорпоральними методами з урахуванням моніторингу електролітів, сечовини і креатиніну.
Респіраторна підтримка
В умовах розвиненого СІГ пацієнти потребують проведення штучної вентиляції легень (ШВЛ). Респіраторну підтримку слід проводити згідно з концепцією протективної вентиляції з метою запобігання вентилятор-асоційованого пошкодження легень.
Обовʼязковим є підбір оптимального позитив-ного тиску кінця видиху з метою збільшення функціонально активних альвеол за рахунок колабованих базальних сегментів. Недостатній рівень ПТКВ не запобігає колабуванню альвеол на видиху внаслідок високого стояння купола діафрагми, сприяючи розвитку ателектотравми. У свою чергу, надмірно високий рівень ПТКВ погіршує гемодинамічні порушення у звʼязку з ростом внутрішньогруднинного тиску, тому його слід підбирати відповідно до графіка “тиск – обʼєм”.
В умовах ІГ знижується насамперед комплаєнс грудної стінки, а не легень, у звʼязку з чим оптимальним є використання малих дихальних обʼємів (5-6 мл/кг) з метою запобігання баро- і волюмотравмі. Інспіраторна фракція кисню повинна бути мінімально достатньою для нормалізації сатурації змішаної венозної крові. Зниження останньої може бути повʼязане і зі зменшенням доставки кисню в умовах порушення гемодинаміки. Застосування агресивних параметрів ШВЛ на тлі СІАГ може потягти за собою розвиток гострого респіраторного дистрес-синдрому дорослих.