Методи ендоскопічної резекції
Ендоскопічні резекції мають діагностичне і лікувальне значення. Ступінь їх складності прямо залежить від розміру і форми ураження. Застосування різних методів залежить від анатомічного розташування утворення. Тим не менш, в даному розділі описані способи з технологічної точки зору.
Зміст
Загальні аспекти
Біопсія так чи ні?
Усі видимі ураження шлунково-кишкового тракту в принципі потребують діагностичного уточнення. Часто поверхневий малюнок дозволяє лікарю передбачити гістопатологічний об’єкт. Таким чином, корисними є класифікації ямкового малюнку за Кудо (Рис. 1.1) (Toyoshima та ін. 2015) або іншими.

Вони (поки що) не замінюють патогістологічне дослідження.
Необхідність попередньої терапевтичної біопсії обговорюється. Для підтвердження наявності ураження та його основної сутності необхідна біопсія.
З іншого боку, біопсія може не бути інформативною для всього ураження або найбільш поширеної частини пухлини. Слід мати на увазі, що результат біопсії виражає мінімальний ступінь ураження, але не обов’язково остаточну характеристику.
Багато авторів коментують рубці та технічні проблеми з резекцією після біопсії, але доказів цьому немає.
Іншим недоліком є можлива ініціація збільшення лімфатичних вузлів, що може спровокувати визначення стадії пухлини при ендоскопічному ультразвуковому дослідженні.
Тому необхідність біопсії вирішується в індивідуальному порядку. Зокрема, якщо можна розпізнати резектабельність пухлини, біопсія не потрібна.
Якщо є сумніви щодо наявності пухлини і якщо пухлина не може бути видалена ендоскопічно, біопсія є обов’язковою.
Коагуляція
Існує загальний консенсус, що для всіх ендоскопічних маніпуляцій з тканинами, включаючи біопсію, повинні бути доведені мінімальні вимоги до згортання крові (результат швидкого тесту понад 65%, кількість тромбоцитів більше 100 000).
Лікарський засіб із 100 мг оцтової кислоти більше не вважається протипоказанням для ендоскопічних маніпуляцій. Для детальної інформації є спеціальний розділ у кінці цієї книги. Також дивіться актуальні рекомендації на домашніх сторінках наукових організацій.
Чистота місця обстеження
Забруднення місця обстеження їжею та фекаліями знижує діагностичну цінність ендоскопії. Крім того, це може спричинити ризик аспірації та перфорації. Експерт повинен вирішити, чи припинити обстеження, чи продовжити очищення шляхом промивання та відсмоктування.
Особливо для ендоскопічних резекцій чітке поле дії є обов’язковим.
Поліпектомія
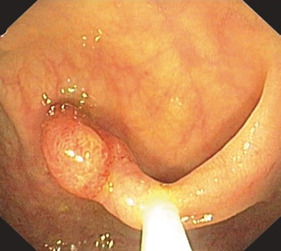
Переважно в лівій частині товстої кишки аденоми зазвичай утворюють пухлину на ніжці з менш або більш тонким поліпом. Це спостереження є основою для терміну «поліп», який не є належним медичним описом. На початку ендолюмінальної діагностики за допомогою барієвих клізм, а пізніше з першими фіброендоскопами цей тип аденоми був першим, який вдалося виявити. Пізніше, з розвитком діагностичної чутливості, були відкриті і плоскі аденоми, але зберігся невдалий термін «поліп». На сьогоднішній день ми знаємо, що колоректальні аденоми мають дуже різні форми, починаючи від ніжкових, сидячих і плоских аденом до аденом із западинами або виразками (Рис. 1.2, 1.3 і 1.4).
Найбільш поширеними і актуальними пухлинами є аденоїди.
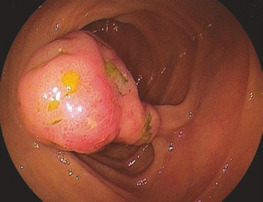
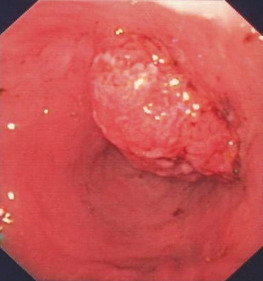
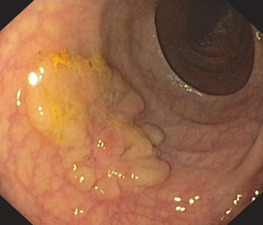
Показання
Більшість поліпів у шлунково-кишковому тракті (ШКТ) є аденомами і, отже, справжньою неоплазією. Вони вимагають повного видалення з діагностичних і терапевтичних міркувань.
Досвідчені експерти можуть оцінити цілісність ураження шляхом тонкого огляду його поверхні. Якщо є сумніви, зразок для гістопатологічного дослідження є обов’язковим. Крім того, ендосонографія може з’ясувати, чи інфільтрує ураження підслизовий шар або глибші частини стінки шлунково-кишкового тракту. У більшості випадків, особливо якщо поліп має видимий поліп, ендосонографія не потрібна.
Поліпектомія показана при:
- Аденоми та поліпозні аденокарциноми
- Гамартоматозні поліпи
- Поліпи Пейтца-Єгерса
- Ювенільні поліпи
Інші поліпи, такі як ліпоми, вимагають видалення, лише якщо вони заважають проходженню, є виразками або кровоточать.
Після апендектомії кукса може бути вивернута завдяки техніці операції. Це імітує сидячий або ніжковий поліп. Це враження посилюється змінами слизової оболонки верхівки кукси апендикса. Виконувати поліпектомію в даній ситуації непотрібно і небезпечно через можливу перфорацію сліпої кишки.
Вимоги до персоналу
Лікуючий лікар повинен бути в змозі впоратися з можливими ускладненнями, такими як кровотеча або перфорація, шляхом ін’єкційної терапії або кліпування. Потрібен один або краще два помічники (крім того, хто контролює аналгоседацію). Один із них повинен мати досвід у вищезгаданих методах.
Технічні вимоги
Для поліпектомії, окрім ендоскопа та аксесуарів до нього, необхідно наступне обладнання:
- ВЧ-генератор зі спеціальними налаштуваннями для ендоскопії (рис. 1.5)
- Нейтральний електрод з кабелем (обережно! маленькі електроди для дітей) (рис. 1.6)
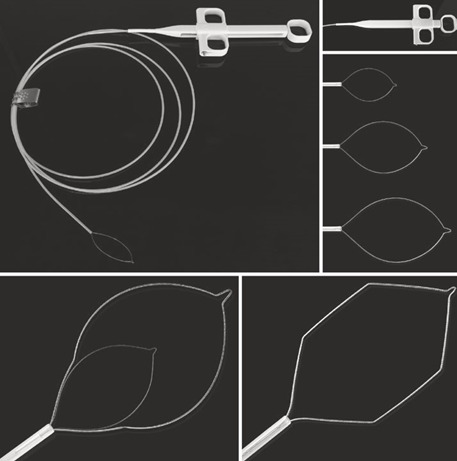
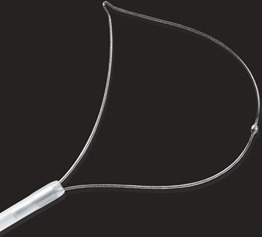
- Поліпектомічні петлі достатнього розміру (принаймні на 5 мм більше самого ураження) (рис. 1.7a–e)
- З’єднувальні кабелі між малим барабаном і високочастотним генератором (увага! Специфічні стандарти виробника)
- Пастка поліпа (особливо якщо кілька поліпів розташовані в правій ободовій кишці)
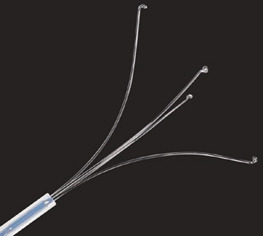
- Інструменти для вилучення поліпів, такі як захвати та сітки (рис. 1.8, 1.9 та 1.10)

Аксесуари для гемостазу
- Обов’язкові: кліпси (рис. 1.11а–в), ін’єкційні голки (рис. 1.12), фізрозчин або розчин адреналіну.
- Додатково: коагуляційний захват (рис. 1.13), аргоноплазмовий коагулятор, ендопетлі (рис. 1.14)


Адміністративні вимоги/налаштування
Передендоскопічна бесіда з пацієнтом повинна включати інформацію та інформовану згоду про поліпектомію та її ускладнення, оскільки кожна ендоскопія може виявити несподівані ураження, які потребують видалення з діагностичних та терапевтичних причин.
За певних обставин (бажання пацієнта, термінові показання до антикоагуляції та низькі докази наявності поліпів) допустиме обстеження без поліпектомії. Крім того, при дуже великих ураженнях із ризикованим видаленням резекцію не слід проводити примусово. Для цих випадків рекомендується додаткова інформація про пацієнта та інші налаштування для видалення, включаючи направлення до спеціалізованих центрів.

Практичне виконання
Якщо попередньої ендоскопії не було, спочатку слід провести повне обстеження, щоб отримати загальне уявлення про кількість, форму та розташування уражень.
У товстій кишці резекцію слід починати з найвищого положення (сліпої кишки), а потім у напрямку до заднього проходу. Оскільки місце резекції є місцем зі зниженим опором, слід уникати непотрібних ендоскопічних проходів.
У верхніх відділах шлунково-кишкового тракту операцію слід проводити від аборального до орального кінця.
Винятками з цієї рекомендації є дуже маленькі або приховані поліпи, які можна негайно видалити біопсійними щипцями або позначити під час першого ендоскопічного проходу.
Якщо обстеження виявляє знахідки, які потребують резекційної операції, показання до видалення подальших уражень залежать від наступної операції. Якщо планується правобічна геміколектомія у зв’язку з карциномою сліпої кишки в лівій півободковій кишці, необхідно видалити кожен поліп для уточнення його злоякісного статусу. Для невеликих уражень рекомендується ендоскопічне татуювання для покращення інтраопераційного розпізнавання пухлини. Уникнення інтраопераційної колоноскопії має деякі логістичні переваги.
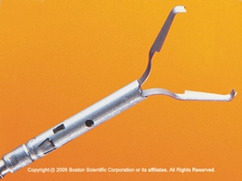
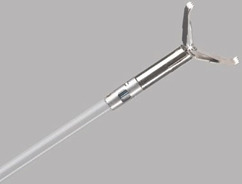
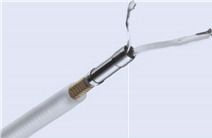

Рис. 1.11 a–d Кліпи. кліп роздільної здатності Boston Scientific. b Гемокліпс Olympus. c Кліп Cook Instinct. d medwork Clipmaster.


Перед початком власне поліпектомії слід розглянути профілактичний гемостаз.
Тому можна використовувати петлі для лігування (як одноразовий виріб або з багаторазовим аплікатором). Розташування петлі лігування має забезпечувати достатню відстань до краю ураження. Профілактичне введення фізіологічного розчину або розведеного розчину норадреналіну (1:10 000) в основу поліпа дешевше. Слід враховувати, що сплощення поліпа, спричинене ін’єкцією, може перешкодити розміщенню пастки. Навіть профілактичне кліпування може ускладнити подальшу резекцію.
З досвіду автора можна обійтися без профілактики кровотечі, особливо при поліпах на ніжці. Пріоритет повинен бути наданий повній резекції; пострезекційний гемостаз є успішним майже у всіх випадках.
| Порада |
|---|
| Перший огляд після резекції необхідно провести на боці резекції. Ураження стінки шлунково-кишкового тракту або джерела кровотечі можна найкраще побачити відразу після резекції. Зразок можна переглянути пізніше (рис. 1.16). |
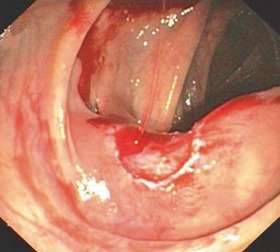
Для розміщення поліпектомічної петлі необхідний відмінний огляд. Залишки фекалій слід видалити шляхом повного промивання. Положення прицілу має бути стабілізовано. Збалансування інсуфляції та аспірації та, якщо необхідно, внутрішньовенне введення Бускопану може допомогти досягти гарної видимості сторони резекції.
При великих поліпах вогнище ураження слід пройти. Після повного розкриття пастки поліп слід зловити, витягнувши приціл із відкритою пасткою.
Закривати пастку за розпорядженням екзаменатора є дуже відповідальним завданням для асистуючої особи. Якщо сітка закрита недостатньо міцно, ураження може вислизнути. Якщо він закритий занадто сильно, існує ризик «холодової пастки», тобто порізу без електрокоагуляції, який може спричинити кровотечу у великих ураженнях. Звичайно, досвід і чітка комунікація всередині команди забезпечують успішну процедуру.
Крім того, існують інші ризики, пов’язані з невдалим розміщенням пастки. Непомічене захоплення здорових складок за межі поліпа може призвести до пошкодження. Якщо петлю розташувати дуже близько до основи, зростає ризик ненавмисної резекції глибших шарів стінки шлунково-кишкового тракту, оскільки м’язового шару.
Якщо є сумніви, пастку слід знову відкрити та переглянути ситуацію. Багато підручників рекомендують уникати контакту з протилежною слизовою оболонкою. У разі великих поліпів це може бути дуже складним або неможливим. Завдяки удосконаленню сучасних ВЧ-генераторів значно зменшено ризики повзучої електроенергії та подальших побічних збитків (рис. 1.17).
Зрізання основи поліпа проводять помірним витягуванням за рукоятку поліпектомічної петлі. Сучасні високочастотні генератори забезпечують спеціальні налаштування для поліпектомії, які складаються з певного почергового застосування енергії різання та гемостазу. Правильне налаштування та використання жовтої педалі для різання є важливими (цей код кольору є міжнародним стандартом, незалежним від виробника).
Раніше практиковане так зване заїкання (повторне короткочасне натискання на педаль) більше не рекомендується, оскільки це компрометує «endo cut» або інші режими різання. Вони містять фазу першого різання, а потім чергуються режими різання та коагуляції.
Це гарантує оптимальний баланс для ефективної профілактики кровотечі та малу зону електрокоагуляції, що дозволяє провести адекватне гістопатологічне дослідження.
Можливі кровотечі та видимі ураження м’язового шару (див. також розділ 3) можна легко впоратися за допомогою ендоскопічних затискачів. Невеликі та дифузні кровотечі можна лікувати місцевими ін’єкціями або термічною терапією з аргоноплазмовою коагуляцією.
! Використання наконечника поліпектомічної петлі для локальної коагуляції є дуже швидким і дешевим. З іншого боку, це небезпечно, оскільки немає контролю за глибиною коагуляції. Тому досвідчені користувачі повинні робити це лише при дуже невеликих кровотечах.
Щоб зібрати поліп, можна використовувати різні методи. Залежно від його консистенції через інструментальний канал можна відсмоктувати поліпи розміром до 8 мм. Для цього між ендоскопом і аспіраційною трубкою можна встановити пастки для поліпів. Це дуже корисно, зокрема, якщо в правій ободовій кишці є кілька поліпів (див. рис. 1.8).
Якщо поліпи занадто великі для трансендоскопічного відсмоктування, їх можна захопити самою петлею. Іноді це важко, і поліп можна розділити сильним витягуванням. Багато виробників пропонують спеціальні захвати для поліпів з трьома або чотирма плечами або ендоскопічні сітки. Останні дуже корисні, зокрема, для збирання кількох поліпів або фрагментів. Їх можна знову відкрити, щоб зловити нові поліпи без втрати раніше спійманих поліпів завдяки їх прилипанню до сітки.
Ще однією перевагою цих пристроїв є можливість спостерігати за слизовою, виймаючи приціл разом із сіткою. Звичайно, великі поліпи можуть бути висмоктані безпосередньо в область і транспортуватися ним. Оскільки це погіршує ендоскопічний огляд, цей метод рекомендовано виключно для сигмовидної та прямої кишки.
Видалені поліпи іноді віддаляються від місця резекції дуже швидко в обох напрямках. Час від часу шукати їх може бути дуже неприємно. Рішення про продовження пошуку поліпа або просіювання калу може бути прийнято на основі індивідуального огляду релевантності.
Ендоскопічна резекція слизової (EMR)
Показання
Ендоскопічна резекція слизової оболонки (ЕМР) є еволюційним розвитком поліпектомії. Застосовується при ураженнях без ніжки. Вони характеризуються найбільшим діаметром біля основи. Задана природою форма ураження визначає метод резекції. Це не є перевагою лікаря.
Оскільки ЕМВ займає більше часу, більше матеріалів і несе в собі більше ризиків, корисно описати його іншим терміном, ніж поліпектомія. Між тим міжнародна класифікація OPS відображає цей розвиток.
Як і поліпектомія, ЕМВ має подвійний характер як діагностичний і як лікувальний захід. Повну резекцію можна розглядати як «тотальну біопсію» і не вимагає попередньої біопсії.
Але тим не менш, щоб почати успішну і повну резекцію, необхідно виконати всі вимоги. Це включає в себе умови пацієнта (інформована згода, коагуляція, відповідне подальше спостереження), ураження (глибина інфільтрації, розмір) і відповідне матеріально-технічне забезпечення (інструментальне та особисте обладнання, часовий інтервал, досвід). Передбачена неповна резекція не рекомендована, оскільки це ускладнює подальше завершення.
Звичайно, глибину інфільтрату можна визначити за допомогою ендоскопічного УЗД. Це добре встановлено для прямої кишки, стравоходу, шлунка та дванадцятипалої кишки; для товстої та тонкої кишки це не так. Оскільки точне визначення стадії пухлини, зокрема глибини інфільтрації підслизового шару, не є надійним, деякі досвідчені ендоскопісти утримуються від ендосонографії. Вони оцінюють стадію пухлини на основі тонкого ендоскопічного огляду.
Тим не менш, автор рекомендує рутинне використання ендосонографії перед резекцією у верхніх відділах ШКТ і прямій кишці через можливе виявлення додаткових знахідок, таких як збільшення лімфатичних вузлів, її безризикове виконання та ефект тренування.
Вимоги до персоналу
Як і при поліпектомії, крім людини для моніторингу аналгоседації необхідні одна або дві особи для допомоги. Особистий досвід важливіший за формальну кваліфікацію особи, яка допомагає. Звичайно, відповідальність несе ендоскопіст. Він повинен усвідомлювати лідерство своєї команди та нести відповідальність за чітку комунікацію.
Інструментальні вимоги
Ендоскопічні резекції слизової оболонки виконуються за принципом петлі. Зокрема, для стравоходу були створені деякі модифікації, спрямовані на спрощення процедури.
Інструментарій для ендоскопічної резекції слизової оболонки
Необхідний
- Поліпектомічна петля
- Ендоскопічна ін’єкційна голка
- Металеві кліпси для гемостазу і, можливо, закриття дефектів
- Пастка для поліпів, ловна сітка або хапач для поліпів
Додаткові інструменти
- Прозорий капюшон (рис. 1.18)
- Асиметричний малий барабан (рис. 1.19)
- Другий захват для двоканального ендоскопа
- Лігатурна система (zB Duette, Cook) (рис. 1.20)

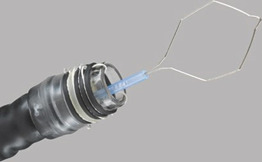
Організаційні вимоги/налаштування
Оскільки часткові резекції слизової спричиняють місцеві рубці, вони серйозно ускладнюють подальше завершення та підвищують ризик неефективності ендоскопічної терапії. На цьому фоні ендоскопічну резекцію слід розпочинати лише в тому випадку, якщо її завершення можна досягти під час того самого сеансу.
Що стосується ЕМВ, це означає, що необхідний повний набір інструментів і пов’язані з пацієнтом вимоги, такі як перевірка згортання крові, достатня підготовка кишечника, інформована згода та аналгоседація. Крім того, слід організувати резервне лікування можливих ускладнень, у тому числі в стаціонарному нагляді та хірургічному ремонті.
Практичне виконання: двоканальний
Ендоскопічна резекція («Захопити і захопити»)
Використання двоканального ендоскопа дає змогу досліджуваному вставити другий захоплюючий інструмент через другий канал поряд із ріжучим інструментом у головному каналі. Ідея полягає в тому, щоб затягнути вогнище ураження в пастку за допомогою захоплюючого інструменту (щипці, захват). Через обмежену доступність двоканальних ендоскопів метод не отримав широкого поширення. Одна з основних проблем інтервенційної ендоскопії залишається невирішеною. Кожен вставлений інструмент можна переміщати тільки всім прицілом. Ось чому два інструменти не можна переміщати незалежно один від одного. Вони не дозволяють тріангуляцію або застосування тяги та протидії.
Навіть прототипи ендоскопів, такі як R-scope від Olympus із двома згинальними сегментами та двома різноорієнтованими ліфтами Albarran, не вирішили проблему. Новим підходом від того ж виробника є EndoLifter.

Це дає змогу досліднику розташувати захоплюючі щипці за межами оптики та відтягнути їх назад незалежно від рухів оптики (рис. 1.21).
Практична процедура: видалення мукозектомії («Suck and Snare»)
Слизову оболонку Барретта в дистальному відділі стравоходу можна резектувати спеціальним методом: технікою «відсмоктуй і пасни».
Через обмежений діаметр в стравоході обмежений кут доступу скопа до стінки стравоходу. Присоски можуть подолати цю перешкоду. Присоски доступні в косих і прямих версіях, максимальним діаметром 20 мм. Розмір вибирається відповідно до діаметра та положення ураження. Вони мають внутрішнє кільце, в якому розміщується асиметричний малий барабан. Це слід підготувати перед початком вставлення прицілу.
Після ретельного ендоскопічного огляду ураження та електричного маркування передбачуваної лінії резекції навколо ураження сканер знімають для пристосування присоски до кінчика сканера. Проходячи повз верхній стравохідний сфінктер, петля може зміщуватися з внутрішнього кільця ковпачка. У цьому випадку необхідно зробити репозицію до стінки шлунка.
Після ідентифікації позначеного ураження тканина буде всмоктуватися в ковпачок. Продовжуючи смоктати, пастка буде закрита з легким натисканням. Це гарантує, що максимальна частина тканини потрапить у пастку.
Ендоскопічний контроль місця резекції показує, чи повністю маркування містяться в зразку. Якщо ні, резекцію можна повторити. Тут важливо уникнути присмоктування м’язового шару до ковпачка.
Особливо у випадках з великими площами для резекції можна використовувати спеціальний інструмент для серійних лігованих резекцій. Система Duette (Cook) пропонує гумки на прозорому капюшоні. Вони будуть застосовуватися, як і при лігуванні. Після цього новостворений «поліп» може бути резецований петлею. Система пропонує швидку та безпечну техніку резекції (Pouw et al. 2010).
Практична процедура: резекція пастки («Snare Alone»)
Поодиноке використання петлі для поліпектомії є найпоширенішим методом ЕМВ. Зокрема, у шлунку, дванадцятипалій кишці, товстій і прямій кишці це стандарт для резекцій слизової оболонки. Враховуючи те, що результати ендоскопічної резекції викликають необхідність подальших хірургічних операцій, проведення ЕМВ є дуже розумною процедурою.
EMR має три одночасні цілі:
- Повна резекція ураження, в ідеалі цільним і зі здоровим краєм без пухлини
- Уникнення резекцій м’язового шару, зокрема тих, які неможливо закрити за допомогою ендоскопії
- Уникнення кровотеч
На думку автора, наведений перелік є черговим. Це відображає досвід того, що кровотечу можна лікувати ендоскопічно майже в кожному випадку. Крім того, видимі ураження м’язового шару можна закрити металевими кліпсами, зокрема, якщо не уражена серозна оболонка (прикрита перфорація). У довгостроковій перспективі місцевий рецидив пухлини може бути більшою проблемою.
Це не повинно виправдовувати необережну техніку резекції, але поточна клінічна практика відкриває багато можливостей для вдосконалення. Сучасна статистика показує, що багато колоректальних аденом лікуються онкохірургічними резекціями через підозру на злоякісність або передбачувану ендоскопічну неоперабельність.
Ефективна підслизова ін’єкція важлива для успішної ЕМВ. Це робиться для того, щоб полегшити захоплення ураження пасткою. Крім того, підслизова ін’єкція розширює підслизову оболонку і запобігає залученню частин м’язового шару в петлю. Підслизова ін’єкція також запобігає кровотечі шляхом здавлення дрібних судин. Нарешті, додавання невеликої кількості адгезивного барвника (наприклад, 1:1000 толуїдинового синього) до рідини для ін’єкцій покращує видимість і розрізнення ураження. Особливо під час тривалих процедур із кількома етапами забарвлення підслизової оболонки допомагає підтримувати огляд (рис. 1.22a–b).
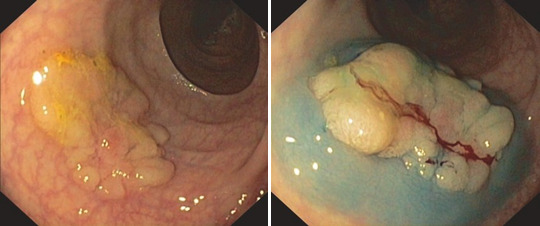
Рис. 1.22 Підслизова ін’єкція аденоми. Плоска нативна аденома. b Плоска аденома після підслизової ін’єкції розчину толуїдинового синього
Найпростішим і дешевим рішенням є ізотонічний сольовий розчин. Додавання адреналіну для запобігання кровотечі не рекомендується. Особливо великі об’ємні ураження потребують великого об’єму для ін’єкції. У цих випадках серцево-судинні побічні ефекти великої кількості адреналіну можуть бути проблематичними.
У випадках з невеликими керованими ураженнями це може зробити ендоскопіст, але доказів ефективності вазоконстрикторів немає.
Різні інші рідини також були протестовані для підслизових ін’єкцій. Гіалуронова кислота виявилася дуже ефективною, але дорогою. Плазморозширювачі, такі як декстран і гідроксиетилкрохмаль 6% дешевші і викликають локальний ефект об’ємної тракції. Вони забезпечують довговічні рідинні подушки, ніж фізіологічний розчин (Sold et al. 2008). Одним з недоліків є їх висока стійкість у процесі ін’єкції.
Введення рідини здійснюється стандартною ін’єкційною голкою. Рекомендується плоска вставка на краю ураження. Поки асистент створює постійний потік тиску за допомогою шприца, голка витягується дуже обережно. Експерт повинен уважно спостерігати за областю і припинити виведення голки, якщо кінчик досягає підслизового шару. Це підтверджується чітко видимим підняттям слизового шару. Цей маневр повторюється навколо вогнища, поки вся пухлина та її оточення не піднімуться. При необхідності ін’єкцію можна зробити і через пухлину.
Особливо у вузьких органах, таких як стравохід і товста кишка, корисно починати ін’єкцію із задньої частини ураження. В іншому випадку ураження може нахилитися назад, і резекція буде неможлива.
| Порада |
|---|
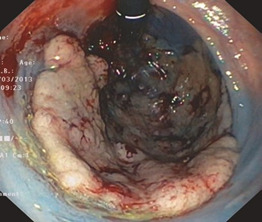
| Як і для підготовки ін’єкції до резекції, дуже корисно працювати з кінчиком трубки в перевернутому положенні. З педіатричними ендоскопами легше інвертувати оптичний приціл. Це не слід робити примусово, щоб уникнути перфорації. Оскільки ця методика змінює шанси на повну резекцію, рекомендовано використання педіатричних колоноскопів як стандарту (рис. 1.23). |
Спеціально для резекції аденоми розміром понад 25 мм була розроблена спеціальна методика, яка використовує водоструминну технологію. Відомий при хірургічному розтині паренхіматозних органів, таких як нирки, печінка, мозок та ін. Тонкий капіляр з’єднується за допомогою спеціального насоса і прикладається до поверхні слизової. На кінчику капіляра знаходиться спеціальний кристал, який утворює когерентний пучок води. Він миттєво проникає в слизову через свій м’який характер. Підслизовий шар стінки шлунково-кишкового тракту складається з тривимірного зв’язку фіброзних волокон, які відбивають промінь у всіх напрямках. Результатом є виділення рідинної подушки в підслизовому шарі (вибіркове підняття тканини тиском = КРОК). Особливо при великих і складних аденомах ця методика дуже корисна (рис. 1.24a–b).
Справжня резекція виконується за допомогою петлі для поліпектомії. Виробники пропонують широкий спектр малих розмірів (15-60 мм), форми (овальні, шестикутні, асиметричні), матеріалу (нітінол, сталь) і обробки (рухливі, плетені). У користувачів різні пріоритети. Згідно з досвідом автора, плетена 30-міліметрова овальна петля є хорошим стандартом, який охоплює більшість випадків.
Більшість пасток мають фігурний наконечник, який допомагає закріпити пастку в одній точці над поразкою. Починаючи з цього моменту, пастка повільно розкривається і розташовується навколо пухлини. Тепер узгоджена координація між обстежувачем і асистентом має вирішальне значення для координації рухів петлі та ендоскопа. Звичайно, помічнику потрібен чіткий огляд монітора.
Перед закриттям пастки дуже важливо зменшити напругу стінки шлунково-кишкового тракту шляхом відсмоктування повітря. Це може означати повний колапс просвіту з втратою зору. Таким чином, навіть плоске пошкодження може потрапити в отвір пастки. Під час закриття пастки лікар повинен штовхати стрічку в напрямку стінки, щоб повністю покрити пошкодження. Асистент повинен знати, що кінцеве натягнення для закриття пастки набагато вище при ЕМВ, ніж при поліпектомії. Необхідно сильне натягнення, щоб уникнути вислизання ураження з пастки. Ризик ненавмисного розрізу («холодної пастки»), як при поліпектомії, незначний.
Після цього проводиться повторна інсуфляція просвіту, і слід контролювати тканину, яка захоплюється пасткою. Ризик цього маневру полягає в тому, що в резекцію включені частини м’язового шару. У разі сумнівів можна перевірити, чи рухається вся стінка шлунково-кишкового тракту чи лише її поверхневі частини. Обережне відкриття пастки дозволяє глибшим шарам стінки вислизнути з пастки. Звичайно, цей вчинок вимагає великого досвіду. Нарешті, залишається певна невизначеність.


Тепер фактична резекція виконується шляхом розрізання за допомогою високочастотного (ВЧ) генератора. Усі виробники мають надати жовті педалі для різання та сині педалі для енергорежимів коагуляції (рис. 1.25).
Суворо рекомендуються генератори зі спеціальними настройками для ендоскопічних резекцій. Ці спеціальні параметри мають (регульовані) послідовності для режимів різання та коагуляції. Безперервне натискання педалі є важливим для їх функціонування (без «заїкання»). Почергове натискання жовтої та синьої педалей знищило б ефект «endo cut». Детальніше дивіться в рекомендаціях виробника ВЧ генератора.
| Порада |
|---|
| Після резекції перший огляд повинен бути спрямований на бік резекції, тому що можливі ураження стінки та кровоточиві судини можна оптимально розпізнати в самий ранній момент після резекції. Таким чином, їх можна лікувати дуже цілеспрямовано. Кліпси повинні бути готові до використання. |
У випадках з великими ураженнями, які неможливо видалити цільно, необхідно виконати фракційну резекцію (поштучну резекцію). Немає строгих рекомендацій починати з оральної або аборальної частини ураження, але перший розріз повинен враховувати всю процедуру. Виступаючі частини пухлини легше потрапити в пастку. Тому вони є хорошим місцем для початку резекції. Це створює опору для подальшого розміщення петлі.
Ресекцію слід продовжувати до повного завершення, коли це можливо. Пізніші резекції скомпрометовані рубцями внаслідок попередніх резекцій.
Затискачі слід застосовувати після завершення резекції, оскільки вони можуть порушити розміщення петлі. Для зупинки артеріальної кровотечі використання спеціального захоплюючого коагуляційного щипця («Coagrasper») на цьому фоні перевершує кліпсу.
Видимі пошкодження м’язового шару слід закривати кліпсами, навіть якщо вони покриті серозою (прикриті перфорації) (рис. 1.26а–б).
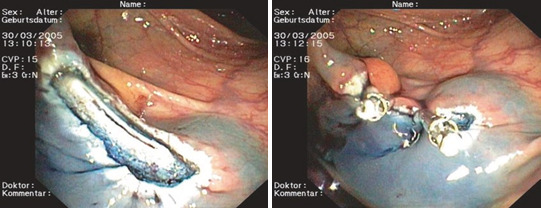
Якщо форма ураження не щілиноподібна, можливо, необхідно звузити його з країв. Для великих уражень рекомендується спеціальний накладний затискач. Його можна накладати за допомогою спеціальних захоплюючих інструментів (якоря або здвоєного захвату). Вони допомагають захопити краї перфорації та протягнути тканину в прозорий ковпак аплікаційної системи.
Якщо у пацієнта виявляється пневмоперитонеум, його слід пунктувати або дренувати, поки вогнище не закриється. Пацієнт повинен отримувати антибіотики та ретельний клінічний нагляд протягом мінімум 48 годин: якщо є будь-які сумніви, очевидно, що готовність до хірургічного втручання є само собою зрозумілою.
! Рішення щодо нехірургічного лікування перфорації є дуже важливим і має бути прийняте протягом розумного періоду часу. Оскільки ендоскопічний дослідник може бути невпевненим, це рішення має прийматися міждисциплінарною групою. Звичайно, важливіше уникнути важкого перитоніту, ніж хірургічного втручання.
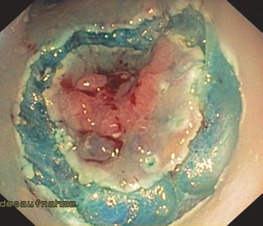
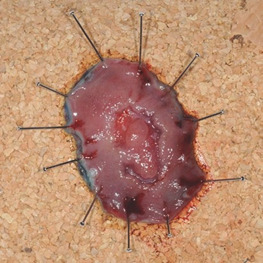
Щоб отримати зразок, існує кілька доступних методів. Дрібні та м’які поліпи можна відсмоктувати через приціл. Тому необхідна спеціальна пастка між прицілом і всмоктуючим пристроєм. Більші екземпляри можна захопити за допомогою пастки або спеціальних захватів для поліпів. У випадках із кількома зразками, особливо в правій ободовій кишці, ендоскопічні сітки дуже корисні. Відповідно до розміру, форми та характеру ураження, експерт повинен зафіксувати його на плоскому матеріалі (корку, пластику) шпильками для покращення гістопатологічного дослідження.
Ендоскопічна підслизова дисекція (ESD)
Показання
Показання до ESD відповідають тим же принципам, що й EMR. ESD показано при всіх пухлинах слизової оболонки з підтвердженою або підозрюваною злоякісністю через ендоскопічні особливості (рис. 1.27).
Глибину інфільтрації, зокрема підслизового шару, можна оцінити за допомогою ендосонографії або спостерігаючи за підслизовою ін’єкцією. Гарне підвищення вважається «позитивною ознакою відриву» та індикатором доброякісних утворень. І навпаки, «негативний підйом» багатьма авторами розглядається як аспект злоякісності. На практиці іноді буває важко зробити надійне розрізнення. Попередні (неповні) ендоскопічні резекції, глибокі біопсії та хронічні запалення також можуть спричинити утворення рубців у підслизовому шарі та, таким чином, негативний відрив.
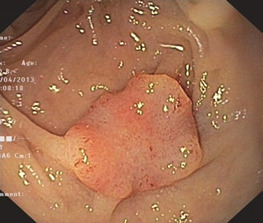
Гістопатологічні критерії високого ризику, такі як мікролімфатична (L+), мікровенозна (V+), периневральна (Pn+) або слабка диференціація пухлини (G > 2) є явними протипоказаннями для ендоскопічних резекцій з лікувальною метою.
Вимоги до персоналу
Для ESD вся команда повинна знати, що це тривала процедура. Для лікування можливих ускладнень і тривалої седації, окрім екзаменатора та асистента, необхідний інший асистент або другий лікар. Повна анестезія не є обов’язковою, але може бути корисною для пацієнтів з ішемічною хворобою серця або серйозною легеневою дисфункцією. Для отримання додаткової інформації див. рекомендації щодо аналгоседації в ендоскопії. У разі сумнівів зверніться до анестезіолога.

Вимоги до приладів
Для ESD необхідні наступні пристрої:
- HF генератор зі спеціальними налаштуваннями, пов’язаними з ендоскопією
- Інструменти для ін’єкції: ін’єкційна голка або гібридний ніж з водоструменем
- Рідини для підслизових ін’єкцій (детальніше див. текст)
- Ніж-голка за бажанням з ізольованим кінчиком (ніж IT) (Мал. 1.30a–d)
- Інструменти для збирання зразка (захват,
- Ендовайзер з боковим адаптером на каналі приладів (рис. 1.28 і 1.29)
- Ніж-голка за бажанням з ізольованим кінчиком (ніж IT) (Мал. 1.30a–d)
- Інструменти для контролю кровотечі (коаграпер, кліпси)
- Інструменти для збирання зразка (захват, сачок)
- Прозорий ковпак для наконечника оптики (рис. 1.31)




Рис. 1.30 a – c Ніж-голка. HybridKnife I-Type. b IT-ніж. c Ніж-гачок. d Подвійний ніж (з люб’язного дозволу Erbe Elektromedizin a , MTW b та Olympus Optical Co c , d )
За бажанням можна використовувати наступні інструменти:
- Великий затиск для закриття на всю товщину (OTSC) із захватом (анкерний та/або подвійний захват)
- Інсуфляція CO2 для ендоскопа (рис. 1.32)
- Пристрої для пункції або дренажу вільного газу (наприклад, набір для надлобкової пункції сечового міхура) (рис. 1.33)
Організаційні вимоги/налаштування
Налаштування для ESD явно більш вимогливі, ніж будь-яка інша ендоскопічна процедура. Оскільки тривалість часу важко оцінити, слід запланувати достатній резерв.


Мобільні телефони, пейджери та інші відволікаючі фактори повинні бути заборонені в кімнаті. Команда повинна обговорити підхід до можливих ускладнень, зокрема, якщо потрібне хірургічне лікування. Ідеальним є спеціальне навчання команди перед початком ОУР.
Практична процедура
Через тривалу тривалість складного ЕСД необхідно дотримуватися деяких особливих аспектів, як і під час хірургічної процедури. Постільна білизна хворого повинна уникати охолодження, а також парезів через тривале здавлення периферичних нервів. Слід враховувати, що може знадобитися зміна положення хворого з тактичних міркувань.
Фактична процедура починається після промивання та орієнтації навколо ураження, з позначенням планової лінії резекції за допомогою електрокоагуляції або аргоноплазмової коагуляції (АРК). Ці позначки повинні бути на відстані не менше 5 мм від пухлини. Видимість цих позначок має вирішальне значення, оскільки під час процедури огляд зменшується. В іншому випадку повнота резекції є основою онкологічного успіху.
Для розмітки наявної голки можна використовувати ножі. Використання АПК є менш травматичним для слизової оболонки, але пов’язане з додатковими витратами (рис. 1.34).
Для ін’єкції можна використовувати стандартну голку. Для створення довговічних рідких подушок слід використовувати в’язку речовину. Додавання судинозвужувальних препаратів не рекомендується, оскільки можуть знадобитися великі об’єми, і це може японські автори віддають перевагу гіалуроновій кислоті, але вона є значною. Плазморозширювачі, такі як гідроксиетилкрохмаль (HAES) або декстран, дешеві та доступні всюди. Вони також можуть бути використані для викликання системних побічних ефектів.
Японські автори віддають перевагу гіалуроновій кислоті, але вона експансивна. Плазморозширювачі, такі як гідроксиетилкрохмаль (HAES) або декстран, дешеві та доступні всюди. Вони також можуть бути використані для створення міцних подушок підслизової рідини.
Деякі ESD ножі дають можливість наносити рідину одночасно. Ніж FlushKnife (Fujinon) дає змогу промити цільову ділянку з низьким тиском поруч із ріжучим наконечником (рис. 1.35). Це корисно, якщо слизова вже розкрита. Отже, його використання передбачає попередній розріз слизової оболонки і, таким чином, звичайну ін’єкцію голкою. HybridKnife (Erbe Elektromedizin, Тюбінген, Німеччина) містить центральний канал. Таким чином можна застосувати сфокусований промінь рідини, який проникає через слизову оболонку та вибірково створює рідинну подушку в підслизовому шарі (див. Розділ 3). Це можна повторювати на кожному етапі процедури, не змінюючи інструмент.
Ніж має три різні форми наконечників (рис. 1.36a–c).
Деякі автори додають чорнило для фарбування тканини. Згідно з досвідом автора, додавання низькоконцентрованого толуїдинового синього (1:2500) покращує розпізнавання шарів тканини.
Після цього починається обрізання уражень за межами позначок (рис. 1.37).
Залежно від розміру, форми і положення пухлини можуть застосовуватися різні тактики. Хоча деякі автори починають з повного обрізання, інші залишають невеликий перемичок слизової оболонки як шарнір.

Тактика резекції спрямована на використання сили тяжіння для збільшення підслизового проміжку між зразком і стінкою шлунково-кишкового тракту, можливо, зі зміною положення пацієнта. Виробники пропонують різні ножі, в основному з регульованою довжиною ножа. Кінчик ножа слід просунути на мінімальну довжину, необхідну для проникнення в слизову оболонку. Абсолютна відстань залежить від анатомічного положення ураження. У шлунку робоча дистанція більша, ніж у товстій кишці. Крім того, кут доступу до ураження впливає на просування кінчика голки. Для обрізання особливо рекомендуються ножі з ізольованим наконечником, оскільки вони знижують ризик неконтрольованих порушень м’язового шару на цьому етапі процедури.
Експерт повинен переміщати ендоскоп лівою рукою, а права рука направляє весь ендоскоп штовхаючи, тягнучи, повертаючи або комбінуючи рухи.
Для наступного кроку, розтину підслизової оболонки, до кінчика приціла слід прикріпити прозорий ковпак. Він повинен перевищувати приціл на 5 мм, щоб створити відстань між оптичною лінзою та цільовою тканиною. (Багато ендоскопістів почали використовувати ці ковпачки також для рутинних обстежень, оскільки вони можуть покращити оптичні умови.)
Розсічення підслизової оболонки є найскладнішим і вимогливим етапом процедури. Розсічення необхідно проводити близько до м’язового шару (рис. 1.38). Рухати ножем потрібно строго паралельно стіні. Вибір глибокого підслизового шару обумовлений більше розрідженням кровоносних судин, ніж онкологічними причинами.
Якщо кровоносні судини можна ідентифікувати, їх слід попередньо коагулювати за допомогою коагулятора або ножа. У разі кровотечі необхідний негайний контроль кровотечі, щоб зберегти огляд і, що менш важливо, щоб зберегти кров. Постійний режим очікування промивного пристрою необхідний для локалізації джерела кровотечі. Монополярну коагуляцію можна застосовувати також під водою.
Під час розсічення ендоскопіст завжди повинен орієнтуватися в анатомічній ситуації. Вдихнутий газ і рідини для промивання необхідно періодично видаляти.
У минулому було описано багато методик для покращення підслизової дисекції. Як згадувалося вище, деякі автори змінюють положення пацієнта, щоб використовувати силу тяжіння зразка. Двоканальні ендоскопи, використання магнітів, використання другого ендоскопа або фіксація зовнішнього захоплюючого пристрою (EndoLifter, Olympus Optical) були протестовані для підвищення безпеки та швидкості ESD. Жоден із них не був повністю переконливим. Таким чином, користувач повинен вибрати ту чи іншу з цих технологій залежно від обставин свого пацієнта.
Якщо ураження повністю обрізане, у експерта виникає особлива спокуса використати пастку для завершення резекції. Лікар-ендоскопіст повинен знати, що це несе ризик скомпрометувати результат ESD через розрізання пухлини через недостатній огляд або контроль положення пастки.
Зібрати екземпляр не проблема. Це можна зробити за допомогою присмоктування до кришки, пастки або сітки. Слід контролювати місце резекції на невеликі перфорації. Вони легко закриваються затискачами. Великі ураження можна закрити за допомогою виносної кліпси (Ovesco Endoscopy AG, Тюбінген, Німеччина). Видимі кровоносні судини слід коагулювати для запобігання подальших кровотеч.
Особливо після ESD важливо зафіксувати резецований зразок шпильками в плоскому положенні до відповідного матеріалу, такого як пробка або пластик. Це необхідно для правильного гістологічного дослідження. Деякі ендоскопісти використовують це, щоб орієнтувати зразок для подальшої кореляції між пухлиною та місцем резекції (рис. 1.39).
Звичайний ендоскопічний контроль ділянок ESD необхідний. Рекомендується диспансерне спостереження протягом 24 годин, краще 36 годин. Введення ІПП сприяє загоєнню виразки шлунка. За відсутності перфорацій антибіотики не потрібні.
Ендоскопічна повнотовщина резекція
На відміну від вищевказаних методів, ендоскопічна повна резекція ще не є клінічним стандартом. Ось чому ми описуємо тут принципи різних опублікованих методик. Хочемо зазначити, що ще не встановлено чітких стандартів ні щодо показань, ні щодо техніки.
Закрита повнотовщина резекція
Для уражень розміром не більше 2 см описано дві методики, які підходять, зокрема, для уражень нижнього відділу шлунка. В обох випадках процедура починається зі створення повної товщини плікації та наступної резекції інвертованих частин стінки шлунково-кишкового тракту.
Гнучкі хірургічні степлери (які на даний момент не є комерційно доступними) можна вводити через стравохід у шлунок. Тонкий ендоскоп також можна ввести разом зі степлером і захопити стінку шлунка у відкриті гілки лінійного степлера. При закриванні та стрільбі степлером резекцію виконують після закриття стінки без з’єднання в будь-який час із черевною порожниною (рис. 1.40а–в).
Іншу техніку описали K Caca та ін. при підслизових пухлинах стінки шлунка. За допомогою ендоскопічного зшиваючого пристрою (GerdX; G-Surg GmbH, Traunstein, Німеччина) створюють подвійну плікацію. Після цього може бути виконана петельна резекція повної стінки шлунка без перфорації (рис. 1.41).
Нещодавно компанія Ovesco Endoscopy представила подальшу розробку свого затиску для надскопічного сканування. З’єднується з великим прозорим капюшоном. Спочатку ураження захоплюється та/або всмоктується в ковпачок. Потім кліпса стріляє, і пастка на кінчику капюшона розрізає тканину, яку захоплює кліпса
(Рис. 1.42) (Kaehler et al. 2006; Schurr et al. 2014). Наразі цей пристрій дозволено використовувати лише в товстій і прямій кишці.
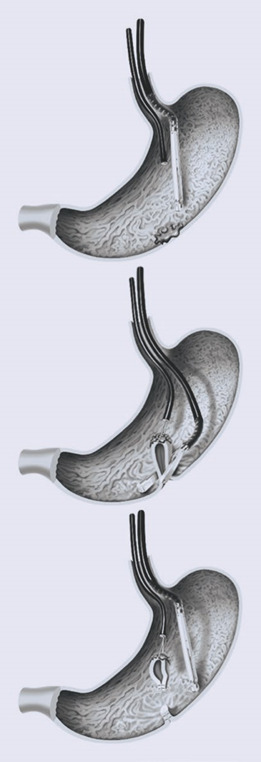
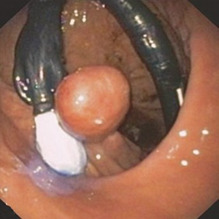
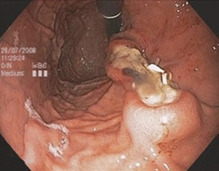
Рис. 1.41 а Схематична демонстрація методу. Штучний поліп створюється шляхом зашивання повної товщини під вогнищем ураження. b Ендоскопічний вид ураження після розтину швів. c Огляд після резекції підслизової оболонки у вигляді повної резекції

Відкрита ендоскопічна повна резекція
На основі ендоскопічного лікування перфорацій було розроблено деякі методи, які забезпечують закриття стінки шлунково-кишкового тракту. Певною мірою ці методи можна використовувати для закриття стінки після цілеспрямованого обрізання пухлин.
Зокрема, при щілиноподібних ураженнях ряд гемозатискачів здатний закрити дефект. Це обмежено шириною відкриття кліпс і тим фактом, що гемокліпси здебільшого можуть захоплювати лише шар слизової оболонки. Згаданий раніше OTSC може забезпечити закриття на всю товщину, але це обмежено його розміром до пошкоджень менше 15 мм.
Деякі японські автори опублікували техніку з поєднанням ендолупів і затискачів. Тому розкриту петлю фіксують декількома кліпсами до країв вогнища ураження. Нарешті цикл замикається. Цю техніку можна використовувати навіть при великих дефектах за попередньої умови, щоб стінка шлунково-кишкового тракту була гнучкою в цільовому місці (рис. 1.43).
У всіх відкритих техніках слід враховувати, що наступне пневмо- або капноперитонеум може спричинити проблеми з розкриттям стінки, а також з диханням і кровообігом.
Для всіх методів повної резекції показання повинні бути збалансовані з хірургічними можливостями. Оскільки місцеві хірургічні висічення мають дуже низький рівень ускладнень, ендоскопічні резекції повної товщини можуть бути виправдані, лише якщо вони можуть бути виконані дуже безпечно. У разі післяопераційного болю хворих похилого віку із супутніми захворюваннями слід оперувати раніше, оскільки у них толерантність до перитоніту нижча, ніж у здорових осіб.
Знайшли помилку?
[contact-field label="" required="1" requiredtext="(обов’язково)" placeholder="Ваше ім'я " borderradius="20" borderwidth="1" labellineheight="1.5" bordercolor="#000000" type="name"/] [contact-field label="" required="1" requiredtext="(обов’язково)" placeholder="Вкажіть максимально детально характер помилки або запропонуйте більш коректний варіант перекладу." borderradius="20" borderwidth="1" labellineheight="1.5" bordercolor="#000000" type="textarea"/]